إضافة شغوفة بالإلكترونات
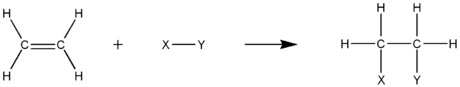
في الكيماء العضوية التفاعلات الشغوفة بالإلكترونات (المحبة للإلكترونات) هى تفاعلات إضافة حيث يتم إزالة رابطة باي من مركب كيميائي بتفاعل رابطتين تساهميتين جديدتين. وفى الإضافة المحبة للإلكترونات غالبا ما تتم للمواد التى بها رابطة كربون-كربون ثنائية أو ثلاثية.
Y-Z + C=C → Y-C-C-Z
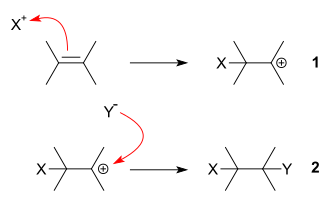
القوة الدافعة لهذا التفاعل هو تكون متفاعل شغوف بالإلكترونات Y+ وهذا يكون رابطة تساهمية مع نظام (-C=C-) مشبع غني بالإلكترونات (الخطوة الأولي).
+step (1) Y+ + -C=C- → Y-C-C-
فى الخطوة الأولي من التفاعل الشغوف بالإلكترونات يتحد المركب الوسيط الموجب الشحنة مع (Z) والذى يكون غني بالإلكترونات لتكوين الرابطة التساهمية الثانية.
step (2) Y-C-C+- + Z → Y-C-C-Z
الخطوة الثانية تتواجد أيضا في تفاعل SN1. العدد المحدد للشغوف بالإلكترونات وطبيعة المركب الوسيط الموجب الشحنة ليست دائما واضحة وتعتمد على المتفاعلات وظروف التفاعل.
وفى كل تفاعلات الإضافات الغير متماثلة للكربون فإن إتجاه سير التفاعل مهم للغاية ويتم تحديده طبقا لقاعدة ماركينيكوف. مركبات البورون العضوية ينتج منها إضافة معاكسة لقاعدة ماركينيكوف. ويحدث هجوم للمتفاعلات المحبة للإلكترونات على الأنظمة الأروماتية وينتج منها إستبدال أروماتي شغوف بالإلكترونات أكثر من تفاعلات الإضافة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تفاعلات الإضافة الشغوفة بالإلكترونات
- تفاعل إضافة ثنائي الهالوجين (dihalo addition reaction)
- هلجنة هيدروجينية
- تفاعل الإماهة (إضافة الماء) (Hydration reaction)
- هدرجة (Hydrogenation)
- تفاعل أكسدة زئبقية (Oxymercuration reaction)
- تفاعل أكسدة هيدروبورونية (Hydroboration-oxidation reaction)
شاهد أيضا
- أنواع تفاعلات الكيمياء العضوية الأخرى هى تفاعلات الإضافة, تفاعلات نزع, تفاعلات إستبدال, تفاعلات إعادة ترتيب, تفاعلات إختزال عضوية.
المصادر
- ويكيبيديا الإنجليزية.