يوديد الفضة

| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Silver(I) iodide
| |
| أسماء أخرى
Argentous iodide
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.029.125 |
| رقم EC |
|
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | AgI |
| كتلة مولية | 234.77 g/mol |
| المظهر | yellow, crystalline solid |
| الرائحة | odorless |
| الكثافة | 5.68 g/cm3, solid[2] |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 0.03 mg/L (20 °C)[2] |
| نتاج قابلية الذوبان، Ksp | 8.52 × 10 −17[1] |
| القابلية المغناطيسية | −80.0·10−6 cm3/mol[3] |
| البنية | |
| البنية البلورية | Hexagonal, hP4 |
| الزمرة الفراغية | P63mc, No. 186 |
| ثابت العقد | a = 0.4591 nm, c = 0.7508 nm |
| ثابت العقد | α = 90°, β = 90°, γ = 120° |
| Dipole moment | 4.55 D[4] |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−61.8 kJ·mol−1 |
| Standard molar entropy S |
115.5 J·mol−1·K−1 |
| سعة الحرارة النوعية، C | 56.8 J·mol−1·K−1 |
| المخاطر | |
| صفحة بيانات السلامة | Sigma-Aldrich |
| ن.م.ع. مخطط تصويري | 
|
| ن.م.ع. كلمة الاشارة | Warning |
| H410 | |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Non-flammable |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
يوديد الفضة Silver iodide هو مركب لاعضوي له الصيغة AgI ، ويكون على شكل بلورات صفراء زاهية عديمة الرائحة، ولكن بعض العينات تحتوي شوائب فضة فلزية تعطي تلوّن رمادي. تسمم الفضة يحدث بسبب بعض العينات AgI يمكن أن تكون ذات حساسية ضوئية عالية. هذه الخاصية تُستغَل في التصوير الضوئي المبني على الفضة. كما يُستخدم يوديد الفضة كمعقم وفي تلقيح السحاب.
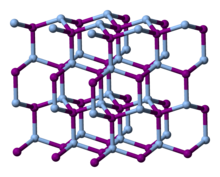
البنية
The structure adopted by silver iodide is temperature dependent:[6]
- Below 420 K, the β phase of AgI, with the wurtzite structure, is most stable. This phase is encountered in nature as the mineral iodargyrite.
- Above 420 K, the α phase becomes more stable. This motif is a body-centered cubic structure which has the silver centers distributed randomly between 6 octahedral, 12 tetrahedral and 24 trigonal sites.[7] At this temperature, Ag+ ions can move rapidly through the solid, allowing fast ion conduction. The transition between the β and α forms represents the melting of the silver (cation) sublattice. The entropy of fusion for α-AgI is approximately half that for sodium chloride (a typical ionic solid). This can be rationalized by considering the AgI crystalline lattice to have already "partly melted" in the transition between α and β polymorphs.
- A metastable γ phase also exists below 420 K with the zinc blende structure.
 The golden-yellow crystals on this mineral sample are iodargyrite, a naturally occurring form of β-AgI. |
التحضير والخواص
حسب جداء انحلال المركب فإن ما ينحل من يوديد الفضة 0.03 مغ فقط لكل ليتر ماء.
- KS = c [Ag+] . c [I -] = 8.5 * 10 -17
كما أنه ضعيف الانحلالية أيضاً في محاليل الأمونياك والثيوسلفات، ويخالف بذلك بوضوح كلا من كلوريد وبروميد الفضة، ولهذا الخاصية أهمية تحليلية للكشف عن مزائج من هالوجينات الفضة.
ينحل يوديد الفضة في محلول اليود وفي محاليل السيانيدات حيث يشكل معقدات منحلة.
- ينصهر يوديد الفضة إلى سائل أحمر اللون، بتبريده نحصل على صلب أصفر شاف.
التحضير
يحضر مركب يوديد الفضة من تفاعل محلول نترات الفضة مع ملح من أملاح اليود مثل يوديد البوتاسيوم على سبيل المثال حيث يترسب يوديد الفضة على شكل راسب أصفر من المحلول حسب المعادلة:
- AgNO3 + KI → AgI↓ + KNO3
الاستخدامات
- لمركب يوديد الفضة تطبيق هام في الاستمطار، وذلك بسبب البنية البلورية المشابهة لبلورات الجليد، حيث يسبب في طبفات الجو العليا نوى تبلور.
تلقيح السحاب
 Cessna 210 equipped with a silver iodide generator for cloud seeding |
The crystalline structure of β-AgI is similar to that of ice, allowing it to induce freezing by the process known as heterogeneous nucleation. Approximately 50,000 kg are used for cloud seeding annually, each seeding experiment consuming 10–50 grams.[8] (see also Project Stormfury, Operation Popeye).[بحاجة لمصدر]
السلامة
Extreme exposure can lead to argyria, characterized by localized discolouration of body tissue.[9]
المصادر
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
الهامش
- ^ Haynes, p. 5.178
- ^ أ ب Haynes, p. 4.84
- ^ Haynes, p. 4.130
- ^ Haynes, p. 9.65
- ^ "C&L Inventory". echa.europa.eu. Retrieved 15 December 2021.
- ^ Binner, J. G. P.; Dimitrakis, G.; Price, D. M.; Reading, M.; Vaidhyanathan, B. (2006). "Hysteresis in the β–α Phase Transition in Silver Iodine" (PDF). Journal of Thermal Analysis and Calorimetry. 84 (2): 409–412. CiteSeerX 10.1.1.368.2816. doi:10.1007/s10973-005-7154-1. S2CID 14573346.
- ^ Hull, Stephen (2007). "Superionics: crystal structures and conduction processes". Rep. Prog. Phys. 67 (7): 1233–1314. doi:10.1088/0034-4885/67/7/R05. S2CID 250874771.
- ^ Phyllis A. Lyday "Iodine and Iodine Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI:10.1002/14356007.a14_381
- ^ "Silver Iodide". TOXNET: Toxicogy Data Network. U.S. National Library of Medicine. Retrieved 9 March 2016.
