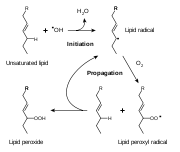
مضاد تأكسد

مضاد الأكسدة هو جزيء قادر على إبطاء أو منع الأكسدة من الجزيئات الأخرى. الأكسدة هي تفاعل كيميائي يقوم بنقل إلكترون من مادة إلى عامل مؤكسد. تفاعلات الأكسدة يمكن أن تنتج الجزيئات الحرة ، والتي تبدأ سلسلة من ردود الفعل التى تحدث ضررا بالخلايا. المواد المضادة للاكسدة تنهى هذه سلسلة من ردود الفعل من خلال إزالة الجزيئات الحرة الوسيطة ، وتكبح تفاعلات الأكسدة الأخرى التي تجرى بأكسدة أنفسها. نتيجة لذلك ، غالبا ما تكون المواد المضادة للاكسدة هي مواد مختزلة مثل الثيولات وحمض الاسكوربيك أو البوليفينول.[1] على الرغم من أن تفاعلات الأكسدة ضرورية للحياة ، فإنها يمكن أيضاأن تكون ضارة ، وبالتالي ، فإن النباتات والحيوانات تحتوى على أنظمة معقدة من أنواع متعددة من المواد المضادة للاكسدة مثل جلوتاثيون، وفيتامين سي، وفيتامين هاء وكذلك إنزيمات مثل الكاتلاز، دسموتاز سوبرأوكسيد وعديد من البيروكسيديز .إن مستويات منخفضة من المواد المضادة للاكسدة أو تثبيط من الانزيمات المضادة للأكسدة ، تسبب ضغوطا من الاكسدة قد تسبب وقوع أضرار أو تقتل الخلايا.
 مقالة مفصلة: مكملات غذائية
مقالة مفصلة: مكملات غذائية
كما أن الضغوط التى تسببها الاكسدة قد تكون جزءا هاما من العديد من الأمراض التي تصيب الإنسان ، فإن استخدام المواد المضادة للاكسدة في علم الأدوية إستحوذ على دراسات مكثفة، وخصوصا انها علاج للجلطة والأمراض العصبية. ومع ذلك ، فمن غير المعروف ما اذا كانت الضغوط الناتجة من الاكسدة هي سبب أو نتيجة للمرض. المواد المضادة للأكسدة أيضا تستخدم على نطاق واسع من ضمن المكونات المستخدمة في المكملات الغذائية أملا في الحفاظ على الصحة والوقاية من الأمراض مثل السرطان وأمراض القلب التاجية. وعلى الرغم من ذلك فإن الدراسات الأولية تشير إلى أن مضادات الأكسدة التكميلية قد تسهم بتعزيز الصحة ، في وقت لاحق أثبتت تجارب سريرية لم تكتشف أية فائدة من مضادات الأكسدة، واقترحت بدلا من ذلك أن المكملات الغذائية الزائدة قد تكون ضارة..[2] بالإضافة إلى هذه الاستخدامات من مضادات الأكسدة الطبيعية في الطب، فإن هذه المركبات لها العديد من الاستخدامات الصناعية، مثل عملها كمواد حافظة في المواد الغذائية ومستحضرات التجميل ومنع تدهور المطاط والبنزين.
التاريخ
إن مضادات الأكسدة كانت مصطلحا يستخدم في الأصل تحديدا مشيرا إلى المادة الكيميائية التي تمنع استهلاك الأوكسجين. برزت هذه الدراسة في وقت متأخر من القرن التاسع عشر وأوائل القرن العشرين ، وقد وضعت دراسات مكثفة كانت مكرسة لاستخدامات المواد المضادة للاكسدة في العمليات الصناعية الهامة ، مثل الوقاية من تآكل المعادن ،وفلكنة المطاط ، و بلمرة الوقود في محركات الاحتراق الداخليs.[3] في وقت مبكر كان البحث عن دور المواد المضادة للاكسدة في البيولوجيا التي تركز على استخدامها في منع الأكسدة للدهون غير المشبعة ، والذي هو السبب في تكسر الدهون. [4]نشاط مضادات الأكسدة يمكن أن يقاس ببساطة عن طريق وضع الدهون في أوعية مغلقة مع الأوكسجين وقياس معدل استهلاك الأوكسجين. ومع ذلك ، فإنه تحديد فيتامينات أ ، سي ، و فيتامين هاء والمواد المضادة للاكسدة التي أحدثت ثورة في الحقل ، وأدت إلى إعمال أهمية المواد المضادة للاكسدة في الكيمياء الحيوية من الكائنات الحية.[5][6] الآليات الممكنة لنظرية عمل المواد المضادة للاكسدة اكتشفت لأول مرة عندما كان من المسلم به أن أى مادة مضادة للأكسدة من المرجح أن تكون هي نفسها التي تتأكسد بسهولة .[7] البحث في كيفية أن فيتامين هاء قادر أن يمنع عملية البيروكسيدية الدهنية أدت إلى تحديد المواد المضادة للاكسدة والحد من العوامل التي تحول دون تفاعلات الأكسدة ، وغالبا من قبل تحطيم أنواع الاكسجين التفاعلية قبل أن يتمكنوا من إتلاف الخلايا.[8]
حمض الأسكوربيك
حمض الاسكوربيك أو "فيتامين ج" هو أحد مضادات الأكسدة monosaccharide وجدت في كل من الحيوانات والنباتات. بوصفه واحدا من الانزيمات اللازمة لصنع حمض الاسكوربيك قد فقدت من قبل الطفرة خلال تطور البشرية ، يجب أن يكون الحصول عليها من الغذاء وفيتامين أ. [9] ومعظم الحيوانات الأخرى قادرة على إنتاج هذا المركب في أجسادهم ، والتي لا تتطلب عليه في وجباتهم الغذائية. [10] في الخلايا ، فإنه يتم الاحتفاظ في شكل انخفاض رد فعل من قبل مع الجلوتاثيون ، والتي يمكن عن طريق حفز كبريتيد البروتين إيزوميراز وs. glutaredoxin [11] [12] حامض الأسكوربيك هو عامل تخفيض ويمكن أن تقلل ، وبالتالي تحييد ، أنواع الاكسجين التفاعلية مثل بيروكسيد الهيدروجين. [13] بالإضافة إلى تأثيراته المضادة للأكسدة المباشرة ، حمض الاسكوربيك هي أيضا ركيزة للأكسدة البيروكسيديز انزيم أسكوربات ، وهي وظيفة هذا الأمر أهمية خاصة في مقاومة الإجهاد في النباتات. [14] حمض الاسكوربيك موجودا في مستويات عالية في جميع أجزاء النبات ويمكن أن تصل إلى تركيزات 20 millimolar في s. بلاستيدات الخضراء [15]
گلوتاثيون
الجلوتاثيون هو سيستين يحتوى على ببتيد موجود في معظم أشكال الحياة الهوائية. وللجلوتاثيون خصائص المضاد للاكسدة لان مجموعة ثيول في شاردة السيستين هي عامل -اختزال يمكن أن يكون عكسي تتأكسد وتخفيضها. في الخلايا، يتم الاحتفاظ بالجلوتاثيون في شكل مختزل بواسطة أنزيم مختزل الجلوتاثيون ، وهذا بدوره يقلل من الأيضات وغيرها من نظم الانزيم ، مثل أسكوربات في اكسيداز دورة أسكوربات ، اكسيداز الغلوثانيون وglutaredoxin ، فضلا عن الرد مباشرة مع تأكسد. name="MeisterA> نظرا لتركيز عال ودورها المحوري في الحفاظ على الخلية في حالة الأكسدة والاختزال، الجلوتاثيون هو واحد من أهم مضادات الأكسدة الخلوية في بعض الكائنات اكسيداز يتم استبداله thiols الأخرى ، مثل mycothiol في Actinomycete
ميلاتونين
الميلاتونين هو أحد مضادات الأكسدة القوية الذي يمكنه بسهولة عبور أغشية الخلية وحاجز الدم في الدماغ. [16] خلافا لغيره من مضادات الأكسدة، لا يخضع الميلاتونين لاتفاعلات أكسدة-اختزال ، والتي هي قدرةالجزيء المتكررة على الخضوع للاختزال والأكسدة. قد تسمح تفاعلات أكسدة-اختزال لغيرها من مضادات الأكسدة (مثل فيتامين (ج) لتكون بمثابة الموالية للأكسدة، وتعزيز حرية تشكيل جذرية. يمكن أن الميلاتونين ، مرة واحدة أكسدة ، لا يمكن اختزالها إلى حالتها السابقة لأن عدة أشكال نهاية مستقرة للمنتجات على التفاعل مع الجذور الحرة. ولذلك ، فقد كان يشار إلى محطة (أو الانتحارية) المضادة للأكسدة. [17]
أشهر مضادات التأكسد
الأختبارات الأكسيدية في علم الأحياء
أحد مفارقات عملية الأيض هي أن بينما كافة أشكال الحياة بحاجة للأكسجين للبقاء، الأكسجين هو جزيء تفاعلي بشدة الذي يدمر الكائنات الحية بإنتاجه أنواع من الأكسجين النشط. بناءً على ذلك تحتوي الكائنات الحية على شبكو معقدة من الأيضة والأنزيمات مضادة الأكسدة والتي تعمل مع بعضها لمنع أي تلف أكسيدي في المكونات الخلوية كالحمض النووي، البروتين والشحميات. بشكل عام، مضادات الأكسدة هذه إما تقوم بمنع هذه التفاعلات من التشكل، أو إزالتهم قبل إتلاف مكونات حيوية في الخلية.[1] أنواع الأكسجين النشطة التي تنتج في الخلية تتضمن : بَيروكسيدُ الهِيدْروجين (H2O2)، حمض تحت الكلوري (HClO)، بالإضافة إلى الجَذْورٌ الحُرّة كالهيدوكسيل (OH) والأكسيد الفائق (O2−).[2]
المواد الحافظة للأغذية
تستخدم المواد المضادة للأكسدة كمضافات غذائية للمساعدة في منع تدهور الغذاء. إن التعرض للأكسجين وأشعة الشمس هما العاملان الرئيسيان لأكسدة المواد الغذائية، فيتمّ الحفاظ على الطعام بختمه أو تغطيته بطلاء الشمع وتركه في الظلام.
توكوفيرول و توكوتراي إينولز (فيتامين إى)
Vitamin E is the collective name for a set of eight related tocopherols and tocotrienols, which are fat-soluble vitamins with antioxidant properties.[18][19] Of these, α-tocopherol has been most studied as it has the highest bioavailability, with the body preferentially absorbing and metabolising this form.[20]
It has been claimed that the α-tocopherol form is the most important lipid-soluble antioxidant, and that it protects membranes from oxidation by reacting with lipid radicals produced in the lipid peroxidation chain reaction.[18][21] This removes the free radical intermediates and prevents the propagation reaction from continuing. This reaction produces oxidised α-tocopheroxyl radicals that can be recycled back to the active reduced form through reduction by other antioxidants, such as ascorbate, retinol or ubiquinol.[22] This is in line with findings showing that α-tocopherol, but not water-soluble antioxidants, efficiently protects glutathione peroxidase 4 (GPX4)-deficient cells from cell death[23]. GPx4 is the only known enzyme that efficiently reduces lipid-hydroperoxides within biological membranes.
However, the roles and importance of the various forms of vitamin E are presently unclear,[24][25] and it has even been suggested that the most important function of α-tocopherol is as a signaling molecule, with this molecule having no significant role in antioxidant metabolism.[26][27] The functions of the other forms of vitamin E are even less well-understood, although γ-tocopherol is a nucleophile that may react with electrophilic mutagens,[20] and tocotrienols may be important in protecting neurons from damage.[28]
أنشطة محفزات الأكسدة
Antioxidants that are reducing agents can also act as pro-oxidants. For example, vitamin C has antioxidant activity when it reduces oxidizing substances such as hydrogen peroxide,[29] however, it will also reduce metal ions that generate free radicals through the Fenton reaction.[30][31]
- 2 Fe3+ + Ascorbate → 2 Fe2+ + Dehydroascorbate
- 2 Fe2+ + 2 H2O2 → 2 Fe3+ + 2 OH· + 2 OH−
The relative importance of the antioxidant and pro-oxidant activities of antioxidants are an area of current research, but vitamin C, for example, appears to have a mostly antioxidant action in the body.[30][32] However, less data is available for other dietary antioxidants, such as vitamin E,[33] or the polyphenols.[34]
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةSies - ^ Bjelakovic G; et al. (2007). "Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis". JAMA. 297 (8): 842–57. doi:10.1001/jama.297.8.842. PMID 17327526.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ^ Matill HA (1947). Antioxidants. Annu Rev Biochem 16: 177–192.
- ^ German J (1999). "Food processing and lipid oxidation". Adv Exp Med Biol. 459: 23–50. PMID 10335367.
- ^ Jacob R (1996). "Three eras of vitamin C discovery". Subcell Biochem. 25: 1–16. PMID 8821966.
- ^ Knight J (1998). "Free radicals: their history and current status in aging and disease". Ann Clin Lab Sci. 28 (6): 331–46. PMID 9846200.
- ^ Moreau and Dufraisse, (1922) Comptes Rendus des Séances et Mémoires de la Société de Biologie, 86, 321.
- ^ Wolf G (2005). "The discovery of the antioxidant function of vitamin E: the contribution of Henry A. Mattill". J Nutr. 135 (3): 363–6. PMID 15735064.
{{cite journal}}: Unknown parameter|day=ignored (help); Unknown parameter|month=ignored (help) - ^ Smirnoff N (2001). "L-ascorbic acid biosynthesis". Vitam Horm. 61: 241–66. doi:10.1016/S0083-6729(01)61008-2. PMID 11153268.
- ^ Linster CL, Van Schaftingen E (2007). "Vitamin C. Biosynthesis, recycling and degradation in mammals". FEBS J. 274 (1): 1–22. doi:10.1111/j.1742-4658.2006.05607.x. PMID 17222174.
- ^ Meister A (1994). "Glutathione-ascorbic acid antioxidant system in animals". J Biol Chem. 269 (13): 9397–400. PMID 8144521.
- ^ Wells W, Xu D, Yang Y, Rocque P (1990). "Mammalian thioltransferase (glutaredoxin) and protein disulfide isomerase have dehydroascorbate reductase activity". J Biol Chem. 265 (26): 15361–4. PMID 2394726.
{{cite journal}}: Unknown parameter|day=ignored (help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Padayatty S, Katz A, Wang Y, Eck P, Kwon O, Lee J, Chen S, Corpe C, Dutta A, Dutta S, Levine M (2003). "Vitamin C as an antioxidant: evaluation of its role in disease prevention". J Am Coll Nutr. 22 (1): 18–35. PMID 12569111.
{{cite journal}}: Unknown parameter|day=ignored (help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Shigeoka S, Ishikawa T, Tamoi M, Miyagawa Y, Takeda T, Yabuta Y, Yoshimura K (2002). "Regulation and function of ascorbate peroxidase isoenzymes". J Exp Bot. 53 (372): 1305–19. doi:10.1093/jexbot/53.372.1305. PMID 11997377.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Smirnoff N, Wheeler GL (2000). "Ascorbic acid in plants: biosynthesis and function". Crit. Rev. Biochem. Mol. Biol. 35 (4): 291–314. doi:10.1080/10409230008984166. PMID 11005203.
- ^ Reiter RJ, Carneiro RC, Oh CS (1997). "Melatonin in relation to cellular antioxidative defense mechanisms". Horm. Metab. Res. 29 (8): 363–72. doi:10.1055/s-2007-979057. PMID 9288572.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Tan DX, Manchester LC, Reiter RJ, Qi WB, Karbownik M, Calvo JR (2000). "Significance of melatonin in antioxidative defense system: reactions and products". Biological signals and receptors. 9 (3–4): 137–59. doi:10.1159/000014635. PMID 10899700.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Herrera E, Barbas C (2001). "Vitamin E: action, metabolism and perspectives". J Physiol Biochem. 57 (2): 43–56. PMID 11579997.
- ^ Packer L, Weber SU, Rimbach G (2001). "Molecular aspects of alpha-tocotrienol antioxidant action and cell signalling". J. Nutr. 131 (2): 369S–73S. PMID 11160563.
{{cite journal}}: Unknown parameter|day=ignored (help); Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ أ ب Brigelius-Flohé R, Traber M (1999). "Vitamin E: function and metabolism". FASEB J. 13 (10): 1145–55. PMID 10385606.
{{cite journal}}: Unknown parameter|day=ignored (help); Unknown parameter|month=ignored (help) - ^ Traber MG, Atkinson J (2007). "Vitamin E, antioxidant and nothing more". Free Radic. Biol. Med. 43 (1): 4–15. doi:10.1016/j.freeradbiomed.2007.03.024. PMID 17561088.
- ^ Wang X, Quinn P (1999). "Vitamin E and its function in membranes". Prog Lipid Res. 38 (4): 309–36. doi:10.1016/S0163-7827(99)00008-9. PMID 10793887.
- ^ Seiler A, Schneider M, Förster H, Roth S, Wirth EK, Culmsee C, Plesnila N, Kremmer E, Rådmark O, Wurst W, Bornkamm GW, Schweizer U, Conrad M (2008). "Glutathione peroxidase 4 senses and translates oxidative stress into 12/15-lipoxygenase dependent- and AIF-mediated cell death". Cell Metab. 8 (3): 237–48. doi:10.1016/j.cmet.2008.07.005. PMID 18762024.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Brigelius-Flohé R, Davies KJ (2007). "Is vitamin E an antioxidant, a regulator of signal transduction and gene expression, or a 'junk' food? Comments on the two accompanying papers: "Molecular mechanism of alpha-tocopherol action" by A. Azzi and "Vitamin E, antioxidant and nothing more" by M. Traber and J. Atkinson". Free Radic. Biol. Med. 43 (1): 2–3. doi:10.1016/j.freeradbiomed.2007.05.016. PMID 17561087.
- ^ Atkinson J, Epand RF, Epand RM (2007). "Tocopherols and tocotrienols in membranes: A critical review". Free Radic. Biol. Med. 44 (5): 739–764. doi:10.1016/j.freeradbiomed.2007.11.010. PMID 18160049.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Azzi A (2007). "Molecular mechanism of alpha-tocopherol action". Free Radic. Biol. Med. 43 (1): 16–21. doi:10.1016/j.freeradbiomed.2007.03.013. PMID 17561089.
- ^ Zingg JM, Azzi A (2004). "Non-antioxidant activities of vitamin E". Curr. Med. Chem. 11 (9): 1113–33. PMID 15134510.
- ^ Sen C, Khanna S, Roy S (2006). "Tocotrienols: Vitamin E beyond tocopherols". Life Sci. 78 (18): 2088–98. doi:10.1016/j.lfs.2005.12.001. PMC 1790869. PMID 16458936.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Duarte TL, Lunec J (2005). "Review: When is an antioxidant not an antioxidant? A review of novel actions and reactions of vitamin C". Free Radic. Res. 39 (7): 671–86. doi:10.1080/10715760500104025. PMID 16036346.
- ^ أ ب Carr A, Frei B (1999). "Does vitamin C act as a pro-oxidant under physiological conditions?". FASEB J. 13 (9): 1007–24. PMID 10336883.
{{cite journal}}: Unknown parameter|day=ignored (help); Unknown parameter|month=ignored (help) - ^ Stohs SJ, Bagchi D (1995). "Oxidative mechanisms in the toxicity of metal ions". Free Radic. Biol. Med. 18 (2): 321–36. doi:10.1016/0891-5849(94)00159-H. PMID 7744317.
- ^ Valko M, Morris H, Cronin MT (2005). "Metals, toxicity and oxidative stress". Curr. Med. Chem. 12 (10): 1161–208. doi:10.2174/0929867053764635. PMID 15892631.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Schneider C (2005). "Chemistry and biology of vitamin E". Mol Nutr Food Res. 49 (1): 7–30. doi:10.1002/mnfr.200400049. PMID 15580660.
- ^ Halliwell, B (2008). "Are polyphenols antioxidants or pro-oxidants? What do we learn from cell culture and in vivo studies?". Archives of Biochemistry and Biophysics. 476 (2): 107–112. doi:10.1016/j.abb.2008.01.028. PMID 18284912.
{{cite journal}}: More than one of|author=and|last1=specified (help)