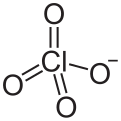
فوق كلورات
|
| |||

| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك النظامي
Perchlorate[1] | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.152.366 | ||
| مرجع Gmelin | 2136 | ||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | ClO4- | ||
| كتلة مولية | 99.451 g mol-1 | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
فوق الكلورات أو الپركلورات Perchlorate هي المركبات المشتقة من حمض البركلوريك (HClO4). هنالك طريقة سهلة في صناعة البركلورات وهي إضافة غاز الكلور إلى محلول مركز من هيدروكسيد البوتاسيوم أو هيدروكسيد الصوديوم المسخن إلى درجة 75°.
طريقة توليد غاز الكلور عن طريق إضافة حمض الكبريتيك إلى ملح الطعام NaCl حيث يتصاعد الكلور ذو اللون الاصفر ولكن يجب الحذر حيث انه غاز سام إذا استنشق بكميات كبيرة وهو من أول الغازات السامة التي استخدمت في الحرب العالمية الثانية. يضاف هذا الغاز إلى المحلول المركز المسخن إلى درجة 75 حيث يلاحظ اولا اختفاء اللون الاصفر ثم مرة أخرى يضاف حتى يلاحظ عدم اختفاء اللون ثم يتم نشر المحلول في الشمس حيث يكون التكون هو ملح CLO3
تعريف كيميائي
The chemical notation for the perchlorate ion is ClO−4. The ion has a molecular mass of 99.45 amu.
A perchlorate (compound) is a compound containing this group, with chlorine in oxidation state +7.
- Ammonium perchlorate, NH4ClO4
- Caesium perchlorate, CsClO4
- Lithium perchlorate, LiClO4
- Magnesium perchlorate, Mg(ClO4)2
- Perchloric acid, HClO4
- Potassium perchlorate, KClO4
- Rubidium perchlorate, RbClO4
- Silver perchlorate, AgClO4
- Sodium perchlorate, NaClO4
التفاعلية كمؤكسد
The perchlorate ion is the least reactive oxidizer of the generalized chlorates. This appears to be a paradox, since higher oxidation numbers are expected to be progressively stronger oxidizers, and less stable. A table of reduction potentials of the four chlorates shows that, contrary to expectation, perchlorate is the weakest oxidant among the four in water.[2]
| Half-reaction | E° (V) |
|---|---|
H+ + HOCl + e- → ½Cl2(g) + H2O |
1.63 |
3H+ + HOClO + 3e- → ½Cl2(g) + 2H2O |
1.64 |
6H+ + ClO3- + 5e- → ½Cl2(g) + 3H2O |
1.47 |
8H+ + ClO4- + 7e- → ½Cl2(g) + 4H2O |
1.42 |
½Cl2(g) + e- → Cl- |
1.36 |
ClO- + H2O + 2e- → Cl- + 2OH- |
0.89 |
ClO2- + 2H2O + 4e- → Cl- + 4OH- |
0.78 |
ClO3- + 3H2O + 6e- → Cl- + 6OH- |
0.63 |
ClO4- + 4H2O + 8e- → Cl- + 8OH- |
0.56 |
This shows that the chlorates are stronger oxidizers in acidic conditions than basic conditions, while chlorine is unchanged.
اوكسيأنيونات أخرى
Using Stock nomenclature, if a Roman numeral in brackets follows the word "chlorate", this indicates the اوكسيأنيون contains chlorine in the indicated oxidation state, namely
| الاسم الشائع | Stock name | حالة الأكسدة | الصيغة |
|---|---|---|---|
| تحت كلوريت | Chlorate(I) | +1 | ClO− |
| كلوريت | Chlorate(III) | +3 | ClO2− |
| كلورات | Chlorate(V) | +5 | ClO3− |
| پركلورات | Chlorate(VII) | +7 | ClO4− |
Using this convention, "chlorate" means any chlorine oxyanion. Commonly, "chlorate" refers only to the oxyanion where chlorine is in the +5 oxidation state.
الاستخدامات
مؤكسد
السيارات
فوق الكلورات تستخدم في صناعة الأكياس الهوائية ومسبِّق الشد في حزام المقعد.
الاستخدامات الطبية
الوظائف الحيوية
اكتشاف فوق الكلورات على سطح المريخ
الهامش
- ^ "Perchlorate - PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ^ Cotton, F. A. and Wilkinson, G. "Advanced Inorganic Chemistry" 5th ed. page 564 ©1988, by John Wiley and Sons
| HClO4 | He | |||||||||||||||||
| LiClO4 | Be(ClO4)2 | B(ClO 4)− 4 B(ClO4)3 |
ROClO3 | N(ClO4)3 NH 4ClO 4 NOClO4 |
H 3OClO 4 |
FClO4 | Ne | |||||||||||
| NaClO4 | Mg(ClO4)2 | Al(ClO4)3 Al(ClO 4)− 4 Al(ClO 4)2− 5 Al(ClO 4)3− 6 |
Si | P | S | ClO− 4 ClOClO3 Cl 2O 7 |
Ar | |||||||||||
| KClO4 | Ca(ClO4)2 | Sc(ClO4)3 | Ti(ClO4)4 | VO(ClO4)3 VO2(ClO4) |
Cr(ClO4)3 | Mn(ClO4)2 | Fe(ClO4)2 Fe(ClO4)3 |
Co(ClO4)2, Co(ClO4)3 |
Ni(ClO4)2 | Cu(ClO4)2 | Zn(ClO4)2 | Ga(ClO4)3 | Ge | As | Se | Br | Kr | |
| RbClO4 | Sr(ClO4)2 | Y(ClO4)3 | Zr(ClO4)4 | Nb(ClO4)5 | Mo | Tc | Ru | Rh(ClO4)3 | Pd(ClO4)2 | AgClO4 | Cd(ClO4)2 | In(ClO4)3 | Sn(ClO4)4 | Sb | TeO(ClO4)2 | I | Xe | |
| CsClO4 | Ba(ClO4)2 | Lu(ClO4)3 | Hf(ClO4)4 | Ta(ClO4)5 TaO(ClO4)3 TaO2ClO4 |
W | Re | Os | Ir | Pt | Au | Hg2(ClO4)2, Hg(ClO4)2 |
Tl(ClO4), Tl(ClO4)3 |
Pb(ClO4)2 | Bi(ClO4)3 | Po | At | Rn | |
| FrClO4 | Ra | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | ||||||||||||||||||
| La | Ce(ClO4)x | Pr(ClO4)3 | Nd(ClO4)3 | Pm | Sm(ClO4)3 | Eu(ClO4)3 | Gd(ClO4)3 | Tb(ClO4)3 | Dy(ClO4)3 | Ho(ClO4)3 | Er(ClO4)3 | Tm(ClO4)3 | Yb(ClO4)3 | |||||
| Ac | Th(ClO4)4 | Pa | UO2(ClO4)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||