جسم مضاد مؤنسن
الأجسام المضادة المؤنسنة Humanized antibodies، هي أجسام مضادة من أنواع غير بشرية التي عُدلت تسلسلات الپروتين الخاصة بها لزيادة تشابهها مع متغيرات الأجسام المضادة المُنتـَجة بشكل طبيعي في الجسم البشري.[1][2] عملية "الأنسنة" عادة ما تُجرى على الأجسام المضادة وحيدة النسيلة المطورة لاستخدامها في الجسم البشري (على سبيل المثال، الأجسام المضادة المطورة كأدوية مضادة للسرطان). قد تكون الأنسنة ضرورية عندما تنطوي عملية تطوير أحد الأجسام المضادة على توليد في الجهاز المناعي الغير بشري (مثل الفئران). تسلسلات الپروتين للأجسام المضادة المنتجة بهذه الطريقة تكون مختلفة جزئياً عن الأجسام المضادة المتماثلة التي تحدث بشكل طبيعي في جسم الإنسان، وبالتالي من المحتمل أن تكون مولدة للمناعة immunogenic عند إعطائها للمرضى (انظر أيضاً (جسم مضاد مؤنسن مضاد للفئران Human anti-mouse antibody). هناك أنواع أخرى من الأجسام المضادة المطورة. الأسماء الدولية غير مسجلة الملكية International Nonproprietary Name للأجسام المضادة المؤنسنة تنتهي بـ-zumab، كما في أوماليزوماب omalizumab (انظر تسمية الأجسام المضادة وحيدة النسيلة).
تختلف الأجسام المضادة المؤنسنة عن الأجسام المضادة الكيميرية chimeric antibodies. تمتلك الأخيرة أيضاً تسلسلات الپروتين الخاصة بها والتي عُدلت لتصبح أكثر تشابهاً للأجسام المضادة البشرية، لكنها تحمل امتداد أكبر من الپروتينات الغير برية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
استخدام الدنا المؤشب في عملية الأنسنة
تستفيد عمليات الأنسنة من حقيقة أن إنتاج الأجسام المضادة وحيدة النسيلة يمكن إنتاجها باستخدام الدنا المؤشب recombinant DNA لخلق البُنى[3] القادرة على التعبير في المزرعة الخلوية الثديية. يتم ذلك بعزل عزل قطاعات الجينات القادرة على إنتاج الأجسام المضادة وتنسيلها إلى خلايا قادرة على النمو في مفاعل حيوي مثل پروتينات الأجسام المضادة المنتجة من الدنا في الجينات المنسلة التي يمكن حصادها بشكل جماعي. تتضمن الخطوة دنا مؤشب يوفر نقطة التدخل التي يمكن استغلالها بسهولة لتغيير تسلسل الپروتين للجسم المضاد. وبالتالي، فإن جميع التعديلات التي أجريت على بنية الجسم المضاد التي تحققت في عملية الأنسنة قد تم تفعيلها من خلال تقنيات على مستوى الحمض النووي. لا تتطلب جميع طرق اشتقاق الأجسام المضادة املخصصة لعلاج البشر خطوة الأنسنة (على سبيل المثال عرض الآكلة phage display) ولكن بشكل أساسي، تعتمد جميعها على التقنيات التي تسمح بالمثل "الإدراج" أو "التبادل التدريجي" لأجزاء من جزيء الجسم المضاد.
الاختلاف عن "الجسم المضاد الكيميري"
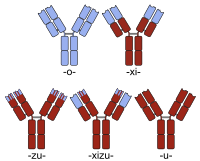
عادة ما ينظر للأنسنة على أنها مختلفة عن خلق كاميرا جسم مضاد بشرية-من الفئران. لذلك، على الرغم من أن خلق كيميرا الجسم المضاد عادة ما يتم إجراؤه لتحقيق جسم مضاد أكثر شبهاً بالأجسام المضادة البشرية (عن طريق استبدال منطقة الشدفة المبتلورة Fragment crystallizable region لدى الفئران في الجسم المضاد بواحدة من الإنسان) لا يشار عادة إلى هذا النوع من الكيميرات البسيطة بالمؤنسنة. بدلاً من ذلك، يكون تسلسل الپروتين للجسم المضاد المتوافق مع البشر متطابقاً جوهرياً مع متغير الجسم البشري، على الرغم من أصله الغير بشري في بعض أقسام complementarity determining region (CDR) المسئولة عن قدرة الجسم المضاد على الارتباط بمستضده المستهدف.
يحتوي الجسم المضاد الكيميري على اللاحقة -xi-. من أمثلة الأجسام المضادة الكيميرية المعتمدة لعلاج الإنسان أبسيكسيماب abciximab (ReoPro)، باسيليكسيماب basiliximab (Simulect)، سيتوكسيماب cetuximab (Erbitux)، إنفليكسيماب infliximab (Remicade)، وريتوكسيماب rituximab (MabThera). هناك أيضاً أمثلة مختلفة على الأجسام المضادة الكيميرية في التجارب السريرية، (مثل باڤيتوكسيماب bavituximab، لأمثلة إضافية انظر القائمة المرتبة.
الأنسنة مقابل الوسيط الكيميري
قد تشمل عملية الأنسنة خلق كيميرا إنسان-فأر في الخطوة الأولى (Fab للفأر يوصل بـ Fc البشرية). بعد ذلك قد يتم إضفاء الطابع الإنساني على الكيميرا عن طريق التغيير الانتقائي لتسلسل الأحماض الأمينية في الجزء الممتد من الجزيء. يجب أن تكون العملية "انتقائية" للاحتفاظ النوعية التي تم تطوير الجسم المضاد في الأصل من أجلها.
الأنسة عن طريق غرس CDRs المتعلق داخل الجسم المضاد البشري
ألمتوزوماب Alemtuzumab هو أحد الأمثلة المبكرة على الجسم المضاد الذي لم تتضمن أنسنته وسيط كيميري. في هذه الحالة، وحيد النسيلة المسمى "Campath-1" تم تطويره ليرتبط مع CD52 بستخدام نظام الفئران. الحلقات فائقة التغير في Campath-1 (التي تحتوي CDRs وبالتالي ينقل قدرته على الارتباط CD52) ثم يتم استخلاصه لاحقاً وغرسزه في إطار جسم مضاد بشري.[1] الألمتوزوماب معتمد لعلاج اللوكيميا الليفماوية المزمنة بائية الخلية B-cell chronic lymphocytic leukemia[4] وهو حالياً قيد التجارب السريرية لعلاج مجموعة أخرى من الامراض منها التصلب المتعدد multiple sclerosis.[5]
الأجسام المضادة لعلاج البشر المشتقة بدون استخدام الفئران
هناك تقنيات يمكنها أن تتجنب بالكامل استخدام الفئران أو الثدييات الغير بشرية الأخرى في عملية استكشاف الأجسام المضادة لعلاج البشر. من أمثلة تلك التقنيات أنظمة تحتوي على طرق "عرض" مختلفة (بصفة رئيسية عرض الآكلة phage display) فضلاً عن طرق التي تستغل مستويات الخلايا البائية المرتفعة التي تحدث أثناء الاستجابة المناعية البشرية.
طرق العرض
تستخدم هذه الطرق المبادئ الانتقائية لإنتاج الأجسام المضادة المحددة ولكنها تستغل العضيات الدقيقة (كما في عرض الآكلة) أو حتى الخلايا المستخلصة بشكل حر (كما في عرض الريبوسوم ribosome display). تعتمد هذه الأنظمة على خلق "مكتبات" جينات الأجسام المضادة التي يمكن اشتقاقها بالكامل من الرنا البشري المعزول من الدم المحيطي peripheral blood. المنتجات الفورية لهذه الأنظمة هي أجزاء الأجسام المضادة، عادة ما تكون Fab أو scFv).
يعني هذا، أنه على الرغم من أن أجزاء الأجسام المضادة المخلقة باستخدام طرق العرض هي تسلسلات بشرية بالكامل، وليست أجسام مضادة كاملة. لذلك، تستخدم العمليات الجوهرية المماثلة لعملية الأنسنة لدمج والتعبير عن الأشباه المشتقة داخل أحد الأجسام المضادة الكاملة.
الأداليموماب Adalimumab (Humira) هو مثال على الأجسام المضادة المعتمدة للعلاج البشري الذي تم تخليقه عن طريق عرض الآكلة.[6][7]
الأجسام المضادة من المرضى أو متلقي اللقاح
من الممكن استغلال رد فعل مناعي عند الإنسان في اكتشاف الأجسام المضادة وحيدة النسيلة. ببساطة، تعمل الاستجابة المناعية البشرية بنفس الطريقة التي تعمل بها لدى الفئران أو غيرها من الثدييات غير البشرية. لذلك، الأشخاص الذين يواجهون تحدياً لنظامهم المناعي، مثل الأمراض المعدية أو السرطان أو اللقاح هم مصدر محتمل للأجسام المضادة وحيدة النسيلة الموجهة لهذا التحدي. يبدو أن هذا النهج مناسباً بشكل خاص لتطوير العلاجات المضادة للپيروسات التي تستغل مبادئ المناعة السلبية passive immunity. وقد ثببت متغيرات هذا المنهج من حيث المبدأ[8] وشقت بعضها طريقها للتطوير التجاري.[9]
انظر أيضاً
المصادر
- ^ أ ب Riechmann L, Clark M, Waldmann H, Winter G (1988). "Reshaping human antibodies for therapy". Nature. 332 (6162): 323–7. doi:10.1038/332323a0. PMID 3127726.
{{cite journal}}: Cite has empty unknown parameter:|month=(help) - ^ Queen C, Schneider WP, Selick HE, Payne PW, Landolfi NF, Duncan JF, Avdalovic NM, Levitt M, Junghans RP, Waldmann TA (Dec 1989). "A humanized antibody that binds to the interleukin 2 receptor". Proc Natl Acad Sci U S A. 86 (24): 10029–33. doi:10.1073/pnas.86.24.10029. PMC 298637. PMID 2513570. (This is an early example of the use of the term "humanized antibody".)
- ^ Norderhaug L, Olafsen T, Michaelsen TE, Sandlie I (May 1997). "Versatile vectors for transient and stable expression of recombinant antibody molecules in mammalian cells". J Immunol Methods. 204 (1): 77–87. doi:10.1016/S0022-1759(97)00034-3. PMID 9202712.
- ^ DrugBank entry for alemtuzumab
- ^ Clinical Trials pages for alemtuzumab
- ^ Kempeni J. (Nov 1999). "Preliminary results of early clinical trials with the fully human anti-TNFalpha monoclonal antibody D2E7". Ann Rheum Dis. 58 (Suppl 1): I70–2. doi:10.1136/ard.58.2008.i70. PMC 1766582. PMID 10577977.
- ^ Rau R (Nov 2002). "Adalimumab (a fully human anti-tumour necrosis factor alpha monoclonal antibody) in the treatment of active rheumatoid arthritis: the initial results of five trials". Ann Rheum Dis. 61 (Suppl 2): 70–3. doi:10.1136/ard.61.suppl_2.ii70. PMC 1766697. PMID 12379628.
- ^ Stacy JE, Kausmally L, Simonsen B, Nordgard SH, Alsøe L, Michaelsen TE, Brekke OH (Dec 2003). "Direct isolation of recombinant human antibodies against group B Neisseria meningitidis from scFv expression libraries". J Immunol Methods. 283 (1–2): 247–59. doi:10.1016/j.jim.2003.09.015. PMID 14659916.
- ^ http://www.theraclone-sciences.com/pdf/Theraclone_ISTAR.pdf Example of method using human patients as source of monoclonal antibodies