أدينوسين ثلاثي الفوسفات سينثاز
| أدينوسين ثلاثي الفوسفات سينثاز ATP Synthase | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
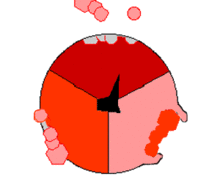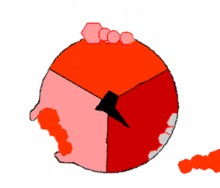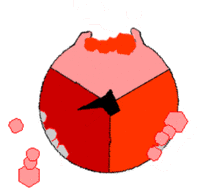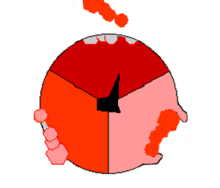
| النمط الجزيئي لأدينوسين ثلاثي الفوسفات سينثاز كما تم التعرف عن طريق دراسة البلورات بالأشعة السينية. لاحظ وضعه بالنسبة للغشاء الداخلي للمتقدرة. | |||||||||
| Identifiers | |||||||||
| EC number | 3.6.3.14 | ||||||||
| CAS number | 9000-83-3 | ||||||||
| Databases | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB structures | RCSB PDB PDBe PDBsum | ||||||||
| Gene Ontology | AmiGO / EGO | ||||||||
| |||||||||
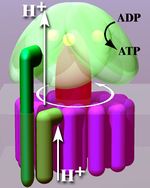
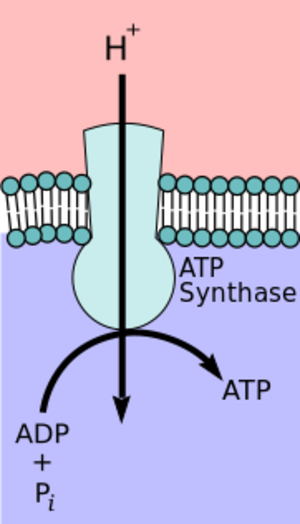
الأدينوسين ثلاثي الفوسفات سينثاز أو إي تي پي سينثاز ATP synthase، هو الانزيم الذي يخلق جزيء تخزين الطاقة الأدينوسين ثلاثي الفوسفات. يستخدم الأدينوسين ثلاثي الفوسفات "تيار الطاقة" الخلوي في معظم العضيات. يتشكل هذا الانزيم من أدينوسين ثنائي الفوسفات وفسفور غير عضوي (Pi). التفاعل الذي يحفزه إي تي پي سينثاز لإطلاق الأدينوسين ثلاثي الفوسفات هو:
- ADP + Pi + H+out
 ATP + H2O + H+in
ATP + H2O + H+in
تشكيل الأدينوسين ثنائي الفوسفات و Pi هو تفاعل غير نشط وعادة ما يتم في اتجاه عكسي. ليتم هذا التفاعل بطريقة غير معكوسة، يقترن جزيئان من الأدينوسين ثلاثي الفوسفات سينثاز أثناء التنفس الخلوي مع متدرج كهروكيميائي والذي ينتج عن الفرق في تركيز الپروتون (H+) عبر غشاء المتقدرة في حقيقيات النوى أو غشاء الپلازما في الجراثيم. أثناء التمثيل الضوئي في النباتات، يتكون الأدينوسين ثلاثي الفوسفات عن طريق أدينوسين ثلاثي الفوسفات سينثاز باستخدام متدرج پروتوني تم تكوينه في تجويف الثايلاكويد عبر غشاء الثايلاكويد وداخل نسيج البلاستيدات الخضراء.
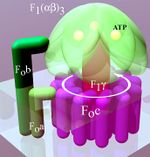
يتألف الأدينوسين ثلاثي الفوسفات سينثاز من وحدتين فرعيتين رئيسيتين، FO وF1، والتي تمتلك آلية حركة دورانية تسمح بإنتاج الأدينوسين ثلاثي الفوسفات.[1][2] بسبب الوحدة الفرعية الدورانية التي يمتلكها الانزيم يعتبر آلة جزيئية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التسمية
التركيب والوظيفة
المنطقة F1
| الوحدة الفرعية | الجين لابشري |
|---|---|
| ألفا | ATP5A1, ATPAF2 |
| بيتا | ATP5B, ATPAF1, C16orf7 |
| گاما | ATP5C1 |
| دلتا | ATP5D |
| إپيسلون | ATP5E |
المنطقة FO
| الوحدة الفرعية | الجين لابشري |
|---|---|
| a | ATP6 |
| b | ATP5F1 |
| c | ATP5G1, ATP5G2, ATP5G3 |
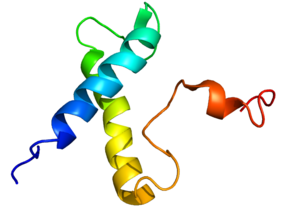
نمط الارتباط
الدور الفسيولوجي
التطور
في الأنواع المختلفة
إ. كولاي
الخميرة
النباتات
الأبقار
البشر
القائمة التالية للجينات البشرية التي ترمز محتويات الأدينوسين ثلاثي الفوسفات سينثاز:
- ATP5A1, ATP5AL1
- ATP5B, ATP5BL1
- ATP5C2, ATP5D, ATP5E, ATP5F1, ATP5G1, ATP5G2, ATP5G3, ATP5H, ATP5HP1, ATP5I, ATP5J, ATP5J2, ATP5L, ATP5L2, ATP5O, ATP5S
- ATP6, ATP6AP1, ATP6AP2
- ATPSBL1, ATPSBL2
- MT-ATP6, MT-ATP8
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
انظر أيضاً
- ATP10 protein required for the assembly of the FO sector of the mitochondrial ATPase complex.
- البلاستيدات الخضراء
- شبكة نقل الإلكترون
- Flavoprotein
- المتقدرة
- Oxidative phosphorylation
- P-ATPase
- ضخ الپروتون
- الحركة الدورانية في الأنظمة الحية
- Transmembrane ATPase
- V-ATPase
المصادر
- ^ Okuno D, Iino R, Noji H (April 2011). "Rotation and structure of FOF1-ATP synthase". Journal of Biochemistry. 149 (6): 655–64. doi:10.1093/jb/mvr049. PMID 21524994.
- ^ Junge W, Nelson N (June 2015). "ATP synthase". Annual Review of Biochemistry. 84: 631–57. doi:10.1146/annurev-biochem-060614-034124. PMID 25839341.
- ^ PDB 5ARA; Zhou A, Rohou A, Schep DG, Bason JV, Montgomery MG, Walker JE, Grigorieff N, Rubinstein JL (October 2015). "Structure and conformational states of the bovine mitochondrial ATP synthase by cryo-EM". eLife. 4: e10180. doi:10.7554/eLife.10180. PMC 4718723. PMID 26439008.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Goodsell, David (December 2005). "ATP Synthase". Molecule of the Month. RCSB PDB. doi:10.2210/rcsb_pdb/mom_2005_12.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ PDB 1VZS; Carbajo RJ, Silvester JA, Runswick MJ, Walker JE, Neuhaus D (2004). "Solution structure of subunit F(6) from the peripheral stalk region of ATP synthase from bovine heart mitochondria". Journal of Molecular Biology. 342 (2): 593–603. doi:10.1016/j.jmb.2004.07.013. PMID 15327958.
قراءات إضافية
- Nick Lane: The Vital Question - Energy, Evolution, and the Origins of Complex Life, Ww Norton, 2015-07-20, ISBN 978-0393088816 (Link points to Figure 10 showing model of ATP synthase)
وصلات خارجية
- Boris A. Feniouk: "ATP synthase — a splendid molecular machine"
- Well illustrated ATP synthase lecture by Antony Crofts of the University of Illinois at Urbana-Champaign.
- Proton and Sodium translocating F-type, V-type and A-type ATPases in OPM database
- The Nobel Prize in Chemistry 1997 to Paul D. Boyer and John E. Walker for the enzymatic mechanism of synthesis of ATP; and to Jens C. Skou, for discovery of an ion-transporting enzyme, Na+ , K+ -ATPase.
- Harvard Multimedia Production Site — Videos — ATP synthesis animation
- David Goodsell: "ATP Synthase- Molecule of the Month"