سوفوسبوڤير
 | |
| البيانات السريرية | |
|---|---|
| الأسماء التجارية | سوڤالدي، ڤيرونون |
| أسماء أخرى | PSI-7977; GS-7977 |
| رمز ATC | |
| المعرفات | |
| |
| رقم CAS | |
| ChemSpider | |
| UNII | |
| ECHA InfoCard | 100.224.393 |
| Chemical and physical data | |
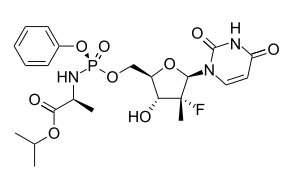
| التركيب | C22H29FN3O9P |
| الكتلة المولية | 529٫46 g·mol−1 |
| 3D model (JSmol) | |
| |
| |
سوفوسبوڤير Sofosbuvir (الأسماء التجارية سوڤالدي Sovaldi وڤيرونون Virunon)، هو دواء يستخدم لعلاج عدوى ڤيروس التهاب الكبد الڤيروسي سي، بمعدلات شفاء عالية.[1][2] يثبط الدواء پوليمراز الرنا التي يستخدمها ڤيروس سي لتكرار الرنا الخاصة به. اكتشف الدواء ريمون سكنازي في شركة فارماست وطورته جلعاد للعلوم.[3]
سوفوسبوڤير هو أول دواء فموي، خالي من الإنترفيرون يحصل على موافقة لاستخدامه في علاج التهاب الكبد الڤيروسي المزمن. [4]
في 2013، حصل سوفوسبوڤير على موافقة هيئة الغذاء والدواء على هيئة مركب مع ريباڤيرين كعلاج فموي مزدوج لالتهاب الكبد الڤيروسي سي النوع 2 و3، وللعلاج الثلاثي مع الحقن بالإنترفرون المضاد للڤيروسات (pegIFN) وRBV للحالات المصابة بإلتهاب الكبد الڤروسي سي النوع 1 و4. [4] يستمر العلاج بسوفوسبوڤير لمدة 12 أسبوع على الأقل للنوع 1 و2 و4، مقارنة ب24 أسبوع للعلاج من النوع 3.[5] تكلف العلاج لمدة 12 أسبوع 84.000 دولار و168.000 دولار ل24 أسبوع، الذي يعتبره بعض المدافعين عن المرضى بأنها تكلفة لا يمكن تحملها.
العلاج الخالي من الإنترفيرون يجنب المريض التأثيرات الجانبية الرئيسية المرتبطة باستخدام الإنترفيرون. فأكثر من نصف المصابين بالتهاب الكبد الڤيروسي سي لا يتحملون إستخدام الإنترفيرون. [6]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الاستخدامات الطبية
العلاج الأولي للـ HCV
In 2016, the American Association for the Study of Liver Diseases and the Infectious Diseases Society of America jointly published a recommendation for the management of hepatitis C. In this recommendation, sofosbuvir used in combination with other drugs is part of all first-line treatments for HCV genotypes 1, 2, 3, 4, 5, and 6, and is also part of some second-line treatments.[7] Sofosbuvir in combination with velpatasvir is recommended for all genotypes with a cure rate greater than 90%, and close to 100% in most cases. The duration of treatment is typically 12 weeks.[7][8]
Sofosbuvir is also used with other medications and longer treatment durations, depending on specific circumstances, genotype and cost-effectiveness–based perspective. For example, for the treatment of genotypes 1, 4, 5, and 6 hepatitis C infections, sofosbuvir can be used in combination with the viral NS5A inhibitor ledipasvir. In genotype 2 and 3 HCV infections, sofosbuvir can be used in combination with daclatasvir. For the treatment of cases with cirrhosis or liver transplant patients, weight-based ribavirin is sometimes added. Peginterferon with or without sofosbuvir is no longer recommended in an initial HCV treatment.[7]
Compared to previous treatments, sofosbuvir-based regimens provide a higher cure rate, fewer side effects, and a two- to four-fold reduced duration of therapy.[9][10][11] Sofosbuvir allows most people to be treated successfully without the use of peginterferon, an injectable drug with severe side effects that is a key component of older drug combinations for the treatment of hepatitis C virus.[12][13]
العلاج الفاشل السابق
For people who have experienced treatment failure with some form of combination therapy for hepatitis C infection, one of the next possible steps would be retreatment with sofosbuvir and either ledipasvir or daclatasvir, with or without weight-based ribavirin. What genotype and particular combination therapy a person was on when the initial treatment failed are also taken into consideration when deciding on which combination to use next. The duration of retreatment can also range from 12 weeks to 24 weeks depending on factors such as which medications are used for the retreatment, whether the person has liver cirrhosis or not, and whether the liver damage is classified as compensated cirrhosis or decompensated cirrhosis.[7]
الحمل والرضاعة
Sofosbuvir alone has been assigned a Pregnancy Category B by the FDA (meaning that it there are no adequate and well-controlled studies in pregnant women but animal reproduction studies have not demonstrated a risk to the fetus and, or that adverse effects have been seen in animal studies, but adequate and well-controlled studies in pregnant women have not, in any trimester). However, ribavirin, a medication that is often given together with sofosbuvir to treat hepatitis C, is assigned a Pregnancy Category X (contraindicated in pregnancy) by the FDA. Pregnant women with hepatitis C who take ribavirin have shown some cases of birth defects and death in their fetus.[14] It is recommended that sofosbuvir/ribarivin combinations be avoided in pregnant females and their male sexual partners in order to reduce harmful fetal defects caused by ribavirin. Females who could potentially become pregnant should undergo a pregnancy test 2 months prior to starting the sofosbuvir/ribavirin/peginterferon combination treatment, monthly throughout the duration of the treatment, and 6 months post-treatment to reduce the risk of fetal harm in case of accidental pregnancy.[14]
It is unknown whether sofosbuvir and ribavirin pass into breastmilk; therefore, it is recommended that the mother does not breastfeed during treatment with sofosbuvir alone or in combination with ribavirin.[15][14]
Contraindications
There are no specific contraindications for sofosbuvir when used alone. However, when used in combination with ribavirin or peginterferon alfa/ribavirin, or others, the contraindications applicable to these agents are applied.[15]
الأعراض الجانبية
Sofosbuvir used alone and in combination with other drugs such as ribavirin with or without a peginterferon has a good safety profile. Common side effects are fatigue, headache, nausea, rash, irritability, dizziness, back pain, and anemia. Most side effects are significantly more common in interferon-containing regimens as compared to interferon-free ones. For example, fatigue and headache are nearly cut in half, influenza-like symptoms are reduced to 3–6% as compared to 16–18%, and neutropenia is almost absent in interferon-free treatment.[15][16]
Sofosbuvir may reactivate hepatitis B in those who have been previously infected.[17]
التفاعلات
Sofosbuvir (in combination with ledipasvir, daclatasvir or simeprevir) should not be used with amiodarone due to the risk of abnormally slow heartbeats.[15]
Sofosbuvir is a substrate of P-glycoprotein, a transporter protein that pumps drugs and other substances from intestinal epithelium cells back into the gut. Therefore, inducers of intestinal P-glycoprotein, such as rifampicin and St. John's wort, could reduce the absorption of sofosbuvir.[15]
In addition, coadministration of sofosbuvir with anticonvulsants (carbamazepine, phenytoin, phenobarbital, oxcarbazepine), antimycobacterials (rifampin, rifabutin, rifapentine), and the HIV protease inhibitor tipranavir and ritonavir is expected to decrease sofosbuvir concentration. Thus, coadministration is not recommended.[15]
The interaction between sofosbuvir and a number of other drugs, such as ciclosporin, darunavir/ritonavir, efavirenz, emtricitabine, methadone, raltegravir, rilpivirine, tacrolimus, or tenofovir disoproxil, were evaluated in clinical trials and no dose adjustment is needed for any of these drugs.[15][18]
الصيدلانية
آلية العمل
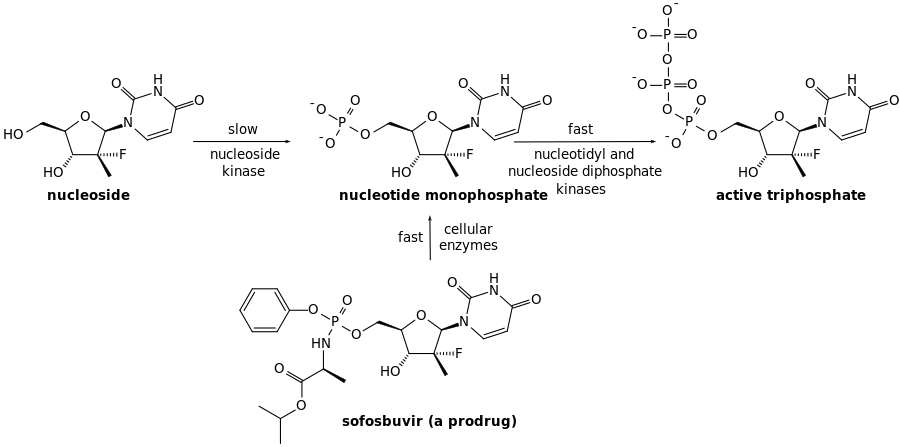
سوفوسبوڤير هو دواء أولي يتم أيضه إلى العامل المضاد للڤيروسات النشطة 2'-deoxy-2'-α-fluoro-β-C-methyluridine-5'-monophosphate.[19] سوفوسبوڤير هو مثبط للنوكليوتيدات التماثلية لپوليمراز التهاب الكبد الڤيروسي سي.[20] پوليمراز HCV أو پروتين NS5B هو پوليمراز رنا يعتمد على الرنا وهو أساسي للدورة الڤيروسية.
Pharmacokinetics
Sofosbuvir is only administered orally. The peak concentration after oral administration is 0.5–2 hours post-dose, regardless of initial dose.[21] Peak plasma concentration of the main circulating metabolite GS-331077 occurs 2–4 hours post-dose.[21] GS-331077 is the pharmacologically inactive nucleoside.[15]
Plasma protein binding of sofosbuvir is 61–65%, while GS-331077 has minimal binding.[15]
Sofosbuvir is activated in the liver to the triphosphate GS-461203 by hydrolysis of the carboxylate ester by either of the enzymes cathepsin A or carboxylesterase 1, followed by cleaving of the phosphoramidate by the enzyme histidine triad nucleotide-binding protein 1 (HINT1), and subsequent repeated phosphorylation.[22] Dephosphorylation creates the inactive metabolite GS-331077. The half life of sofosbuvir is 0.4 hours, and the half life of GS-331007 is 27 hours.[15]
Following a single 400 mg oral dose of sofosbuvir, 80% is excreted in urine, 14% in feces, and 2.5% in expired air recovery. However, of the urine recovery 78% was the metabolite (GS-331007) and 3.5% was sofosbuvir.[21]
الكيمياء
Prior to the discovery of sofosbuvir, a variety of nucleoside analogs had been examined as antihepatitis C treatments, but these exhibited relatively low potency. This low potency arises in part because the enzymatic addition of the first of the three phosphate groups of the triphosphate is slow. The design of sofosbuvir, based on the ProTide approach, avoids this slow step by building the first phosphate group into the structure of the drug during synthesis. Additional groups are attached to the phosphorus to temporarily mask the two negative charges of the phosphate group, thereby facilitating entry of the drug into the infected cell.[19] The NS5B protein is a RNA-dependent RNA polymerase critical for the viral reproduction cycle.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
Sofosbuvir was discovered in 2007 by Michael Sofia, a scientist at Pharmasset, and the drug was first tested in people in 2010. In 2011 Gilead Sciences bought Pharmasset for about $11 billion.[23] Gilead submitted the New Drug Application for sofosbuvir in combination with ribavirin in April 2013, and in October 2013 it received the FDA's Breakthrough Therapy Designation.[24] In December 2013, the FDA approved sofosbuvir in combination with ribavirin for oral dual therapy of HCV genotypes 2 and 3, and for triple therapy with injected pegylated interferon (pegIFN) and RBV for treatment-naive people with HCV genotypes 1 and 4.[25][4] Two months before, the FDA had approved another drug for HepC, simeprevir.[25]
In 2014 the fixed dose combination drug sofosbuvir/ledipasvir, the latter a viral NS5A inhibitor, was approved; it had also been granted breakthrough status.[26]
Prior to the availability of sofosbuvir, hepatitis C treatments involved 6 to 12 months treatment with an interferon-based regimen that provided cure rates of 70% or less and was associated with severe side effects including anemia, depression, severe rash, nausea, diarrhea, and fatigue. As sofosbuvir clinical development progressed, physicians began to "warehouse" people in anticipation of its availability.[27] Sofosbuvir's U.S. launch was the fastest of any new drug in history.[28] Over 60,000 people were treated with sofosbuvir in its first 30 weeks on the U.S. market, about 5% of the U.S. infected population.[29]
موافقة منظمة الغذاء والدواء
تطبيق الدواء الجديد لسوفوسبوڤير تم تقديمه في 8 أبريل 2013 وحصلت صدر تعيين الدواء من منظمة الغذاء والدواء، والذي يمنح الأولوية لمراجع الحالة للأدوية المرشحة والتي قد توفر فرص كبرى للعلاج على الخيارات القائمة. [30]
في 6 ديسمبر 2013، صدقت ادارة الغذاء والدواء على سوڤالدي كعلاج لالتهاب الكبد الڤيروسي سي المزمن.[31]
التفاعل مع أدوية أخرى
في مارس 2015، أرسلت گلعاد للعلوم بريداً إلكترونياً تحذيرياً لمقدمي الرعاية الصحية حول عشرة حالات بدأت بتلقي جرعات من عقار هاردوڤن أو سوڤالدي لعلاج إلتهاب الكبدي سي مع علاجات القلب أميودارون، داكلينزا (داكلاتاسڤير) من بريستول-مايرز سكويب، أو اوليسيو (سيمپرڤير) من جونسون أند جونسون، أؤدي إلى بطئ غير طبيعي في ضربات القلب ووفاة شخص بتوقف القلب. يبنغي إدخال ثلاث منظمات لضربات القلب. أعلنت گلعاد أن الارتباطات بين هذه الأدوية غير موصى بها وأن البطاقات الملصقة على الدواء سيتم تحديثها.[32]
المجتمع والثقافة
الدراسات السريرية
سوفوسبوڤير خضع للدراسة كمركب مع الإنترفرون المضاد للڤيروسات والريباڤيري، مع الريباڤيرين فقط، ومع عوامل أخرى مضادة للڤيروسات بفعالية مباشرة.[33][34] أظهرت تلك الدراسات التأثير السريري الممتاز عند استخدامه سواء مع الإنترفرون المضاد للڤيروسات/الريباڤيرين أو في مركبات خالية من الإنترفرون. وبصفة خاصة، في مركبات السوفوبوڤير مع مثبطات NS5A، مثل داكلاتاسڤير أو GS-5885، ظهرت معددلات الاستجابة الڤيروسية المطردة والتي وصلت لأكثر من 100% لدى الأشخاص المصابون بعدوى التهاب الكبد الڤيروسي سي.[35]
في دراسة لپوسيترون، والتي أجريت على 207 حالة، جميع الحالات لم تستجيب للعلاج بالإنترفرون أو لم ترغب في تناوله، بالرغم من غياب الخيارات علاجية أخرى. ثلاثة أرباع الحالات خضعت لعلاج عشوائي بالسوفوسبوڤير والريباڤيرين، بينما ربع الحالات تلقى علاج بالپالسيبو. أظهرت النتائج أن معدل استجابة إجمالي 78% للحالات التي تلقت علاج بالسوفوسبوڤير و0% للعلاج بالبالپالسيبو. أما بالنسبة للمرضى بالتهاب الكبد الڤيروسي سي النوع 2، فقد أظهرت النتائج معدل شفاء ملحوظ وصل إلى 93%، بينما وصلت معدلات شفاء المرضى بالنوع 3 إلى 61%. [6] الأشخاص المصابون بالتشمع أظهروا معدلات شفاء وصلت إلى 61%، مقارنة ب81% للمرضى الغير مصابون بالتشمع. [6]
في دراسة تجريبية فوجن، على العلاج لفترات مختلفة بالسوفوسبوڤير والريباڤيرين لدى الحالات المصابة بالنوع 2 و3، ظهر فشل العلاج بالإنترفرون. [6] تلقت الحالات علاج لمدة 12 و16 أسبوع. أظهرت النتائج معدلات الشفاء المتزايدة عند العلاج ل16 أسبوع، بالرغم من أن الفارق كان كبير للمصابين بالنوع 3، وصلت معدلات الشفاء عند العلاج ل12 و16 أسبوع إلى 86% و94% للمرضى المصابين بالنوع 2، مقارنة ب30% و62% للمصابين بالنوع 3. [6]
Data from the ELECTRON trial showed that a dual interferon-free regimen of sofosbuvir plus ribavirin produced a 24-week post-treatment sustained virological response (SVR24) rate of 100% for previously untreated patients with HCV genotypes 2 or 3.[36][37]
Data presented at the 20th Conference on Retroviruses and Opportunistic Infections in March 2013 showed that a triple regimen of sofosbuvir, ledipasvir, and ribavirin produced a 12-week post-treatment sustained virological response (SVR12) rate of 100% for both treatment-naive patients and prior non-responders with HCV genotype 1.[38] Gilead has developed a sofosbuvir + ledipasvir coformulation that is being tested with and without ribavirin.
التكلفة
ستصل تكلفة سوفوسبوڤير إلى 84.000 دولار لعلاج مدته ذ12 أسبوع للمرضى المصابين بالنوع 1 و2، و168.000 دولار لعلاج مدته 24 أسبوع للمصابين بالنوع 3.[39] يمثل هذا زيادة كبير في سعر الأدوية السابقة التي كانت تتكون من الإنترفرون والريباڤيرين، والتي كانت تتراوح تكلفتها نبي 15.000 و20.000 دولار. [40] السعر كذلك مرتفع بشكل كبير عن دواء اوليسيو من جونسون أند جونسون والذي تم الموافقة عليه مؤخراً، والذي يصل سعره إلى 50.000 دولار وكذلك عن علاجات التهاب الكبد الڤيروسي المزمن. [40] السعر المرتفع للدواء أدى إلى إستبعاده من شركات التأمين، ومنها إكسپرس سكريپت، والتي هددت ببديل منافس آخر أقل سعراً، حتى لو كانت مواعيد جرعات تلك الأدوية غير ملائمة. [40] الأدوية الأخرى التي دخلت مؤخراً السوق فعاليتها لا تضاهي السوفوسبوڤير، مما مكـّن گلعاد من التحكم في السعر إلى أن تدخل أدوية أخرى منافسة السوق. [40] المدافعون عن المرضى مثل أطباء بلا حدود عبروا احتجوا على السعر، والذي يمثل صعوبة، خاصة في البلدان النامية.[41]
تحديات لبراءة الاختراع
In January 2015 the Indian Patent Office in Mumbai rejected Gilead's patent application.[42][43] That decision was overturned on appeal in February 2015.[44][45]
In February 2015 it was reported[46] that Doctors of the World had submitted an objection to Gilead's patent[47] at the European Patent Office claiming that the structure of sofosbuvir is based on already known molecules.[42] In particular, Doctors of the World argue that the Protide technology powering sofosbuvir has been previously invented by the McGuigan team at Cardiff University in the UK, and that the Gilead drug is not therefore inventive.[48][49] The group filed challenges in other developing world countries as well.[50]
السياحة العلاجية
Due to the high cost of sofosbuvir in the United States, as of 2016 increasing numbers of Americans with hepatitis C were traveling to India to purchase it. Similarly, increasing numbers of Chinese were also traveling to India to purchase sofosbuvir, which had not yet been approved for sale in China by the country's State Food and Drug Administration (SFDA).[51]
البحث
Combinations of sofosbuvir with NS5A inhibitors, such as daclatasvir, ledipasvir or velpatasvir, have shown sustained virological response rates of up to 100% in people infected with HCV. Most studies indicate that the efficacy rate is between 94% and 97%; much higher than previous treatment options.[52][53][54] That treatments could be conducted at very low costs was demonstrated by Hill and coworkers who presented data on 1,160 patients who used generic versions of solfosbuvir, ledipasvir, plus daclatasvir from suppliers in India, Egypt, China and other countries and reported over 90% success at costs of about $50 per therapy.[55]
استخدامه لعلاج كورونا
في 15 يناير 2022 علّق الدكتور يحيى الشاذلي، عضو اللجنة القومية لمكافحة الفيروسات الكبدية بوزارة الصحة، والمنسق العام السابق لحملة القضاء على فيروس سي، على مدى إمكانية علاج مرضى كورونا بدواء السوفالدي.
وقال "الشاذلي" في تصريحات، إنه: "لا علاقة للسوفالدي بعلاج المصابين بڤيروس كورونا".
وأوضح أن "سوفالدي" و"دكلانزا" تعد علاجات تستخدم مع المصابين بفيروس سي لمدة 3 شهور، لأنها "بطيئة وتمنع تكاثر الفيروس، وبالتالي لا تستخدم كعلاجات للأمراض الحادة".
وأشار إلى أن ڤيروس كورونا مرض حاد ويجب إعطاء المريض علاج سريع لمدة 3 أو 4 أيام، وليس 90 يومًا، مضيفًا: "المنطق العام يقول إنها لن تكون فعّالة في علاج كورونا".
وبشأن مدى خطورتها حال إعطائها لمرضى كورونا، قال الشاذلي: "لا نعرف مدى خطورتها، لكن زي اللي بياخد دواء ملوش لازمة، خاصة أنه لا توجد دراسات موثقة بشأن ذلك".
في الأساس، يستخدم سوفالدي ودكلانزا لعلاج مرضى فيروس "سي"، في حين لم تُدرجه وزارة الصحة ضمن بروتوكولها لعلاج مرضى كورونا.
كان الدكتور شريف عباس، استشاري أمراض الجهاز الهضمي والكبد، والطبيب المعالج للإعلامي الراحل وائل الإبراشي، كشف عن إعطائه دواء السوفالدي ودكلانزا لعلاجه خلال العزل المنزلي.
وكان الإبراشي رحل عن عالمنا بشكل مفاجئ يوم 9 يناير 2022، بعد معاناة استمرت لشهور مع كوفيد-19.
وأثارت تصريحات زوجته سحر الإبراشي، بشأن تسبب أحد الأطباء في تدهور حالته الصحية خلال خضوعه للعزل المنزلي، جدلا واسعاً، الأمر الذي ردت عليه نقابة الأطباء بفتح تحقيق في هذا الأمر.
كما تهم الكاتب خالد منتصر، طبيبًا ذكر الحرف الأول من اسمه "ش" بالتسبب في تدهور الحالة الصحية للإبراشي، في الأيام الأولى لإصابته بفيروس كورونا، أواخر عام 2020، وأعطاه "أقراصاً سحرية" لكنها تسببت في سوء حالته.
ومن المقرر بدء أولى جلسات التحقيق مع الدكتور شريف عباس في نقابة الأطباء يوم 18 يناير 2022، بعد أن تقدم بطلب للاستماع إلى أقواله، كما اتهم زوجة الإبراشي ومنتصر بالتشهير به.
وبالتوازي، تقدمت زوجة الإبراشي ببلاغ إلى النائب العام متهمة طبيبه المعالج بالتسبب في وفاته.[56]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
انظر أيضاً
- Tenofovir alafenamide—a nucleotide reverse-transcriptase inhibitor that uses similar phosphoramidate prodrug technology[57][58]
المصادر
- ^ News: United States to approve potent oral drugs for hepatitis C, Sara Reardon, Nature, 30 October 2013
- ^ Sofia MJ, Bao D, Chang W, Du J, Nagarathnam D, Rachakonda S, Reddy PG, Ross BS, Wang P, Zhang HR, Bansal S, Espiritu C, Keilman M, Lam AM, Steuer HM, Niu C, Otto MJ, Furman PA (2010). "Discovery of a β-d-2'-deoxy-2'-α-fluoro-2'-β-C-methyluridine nucleotide prodrug (PSI-7977) for the treatment of hepatitis C virus". J. Med. Chem. 53 (19): 7202–18. doi:10.1021/jm100863x. PMID 20845908.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ "PSI-7977". Gilead Sciences.
- ^ أ ب ت Tucker M (December 6, 2013). "FDA Approves 'Game Changer' Hepatitis C Drug Sofosbuvir". Medscape. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "medscape" معرف أكثر من مرة بمحتويات مختلفة. - ^ "U.S. Food and Drug Administration Approves Gilead's Sovaldi™ (Sofosbuvir) for the Treatment of Chronic Hepatitis C - See more at: http://www.gilead.com/news/press-releases/2013/12/us-food-and-drug-administration-approves-gileads-sovaldi-sofosbuvir-for-the-treatment-of-chronic-hepatitis-c#sthash.T9uTbSWK.dpuf". Gilead. December 6, 2013.
{{cite web}}: External link in|title= - ^ أ ب ت ث ج "Sofosbuvir is safer than interferon for hepatitis C patients, say scientists". News Medical. April 25, 2013.
- ^ أ ب ت ث "Recommendations for Testing, Managing, and Treating Hepatitis C" (PDF). AASLD/IDSA. 27 September 2016. Archived from the original (PDF) on 10 November 2016. Retrieved 10 November 2016.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "EPCLUSA (sofosbuvir and velpatasvir) Prescribing information" (PDF). Gilead Sciences, Inc. Archived from the original (PDF) on 30 June 2017. Retrieved 16 June 2017.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Berden FA, Kievit W, Baak LC, Bakker CM, Beuers U, Boucher CA, Brouwer JT, Burger DM, van Erpecum KJ, van Hoek B, Hoepelman AI, Honkoop P, Kerbert-Dreteler MJ, de Knegt RJ, Koek GH, van Nieuwkerk CM, van Soest H, Tan AC, Vrolijk JM, Drenth JP (October 2014). "Dutch guidance for the treatment of chronic hepatitis C virus infection in a new therapeutic era". The Netherlands Journal of Medicine. 72 (8): 388–400. PMID 25387551.
- ^ Cholongitas E, Papatheodoridis GV (2014). "Sofosbuvir: a novel oral agent for chronic hepatitis C". Annals of Gastroenterology. 27 (4): 331–337. PMC 4188929. PMID 25332066.
- ^ Tran TT (December 2012). "A review of standard and newer treatment strategies in hepatitis C". The American Journal of Managed Care. 18 (14 Suppl): S340-9. PMID 23327540.
- ^ Yau AH, Yoshida EM (September 2014). "Hepatitis C drugs: the end of the pegylated interferon era and the emergence of all-oral interferon-free antiviral regimens: a concise review". Canadian Journal of Gastroenterology & Hepatology. 28 (8): 445–51. PMC 4210236. PMID 25229466.
- ^ Calvaruso V, Mazza M, Almasio PL (May 2011). "Pegylated-interferon-α(2a) in clinical practice: how to manage patients suffering from side effects". Expert Opinion on Drug Safety. 10 (3): 429–35. doi:10.1517/14740338.2011.559161. PMID 21323500.
- ^ أ ب ت "Copegus (Ribavirin, USP Tablets) Medication Guide" (PDF). Roche. Archived from the original (PDF) on 29 October 2014. Retrieved 28 October 2014.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ أ ب ت ث ج ح خ د ذ ر خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةUSlabel2015 - ^ Bhatia HK, Singh H, Grewal N, Natt NK (October 2014). "Sofosbuvir: A novel treatment option for chronic hepatitis C infection". Journal of Pharmacology & Pharmacotherapeutics. 5 (4): 278–84. doi:10.4103/0976-500X.142464. PMC 4231565. PMID 25422576.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFDAwarning2016 - ^ Karageorgopoulos DE, El-Sherif O, Bhagani S, Khoo SH (February 2014). "Drug interactions between antiretrovirals and new or emerging direct-acting antivirals in HIV/hepatitis C virus coinfection". Current Opinion in Infectious Diseases. 27 (1): 36–45. doi:10.1097/QCO.0000000000000034. PMID 24305043.
- ^ أ ب Murakami E, Tolstykh T, Bao H, Niu C, Steuer HM, Bao D, Chang W, Espiritu C, Bansal S, Lam AM, Otto MJ, Sofia MJ, Furman PA (2010). "Mechanism of activation of PSI-7851 and its diastereoisomer PSI-7977". J. Biol. Chem. 285 (45): 34337–47. doi:10.1074/jbc.M110.161802. PMC 2966047. PMID 20801890.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) خطأ استشهاد: وسم<ref>غير صالح؛ الاسم "pmid20801890" معرف أكثر من مرة بمحتويات مختلفة. - ^ Alejandro Soza (November 11, 2012). "Sofosbuvir". Hepaton.
- ^ أ ب ت Kirby BJ, Symonds WT, Kearney BP, Mathias AA (July 2015). "Pharmacokinetic, Pharmacodynamic, and Drug-Interaction Profile of the Hepatitis C Virus NS5B Polymerase Inhibitor Sofosbuvir". Clinical Pharmacokinetics. 54 (7): 677–90. doi:10.1007/s40262-015-0261-7. PMID 25822283.
- ^ Dinnendahl V, Fricke U, eds. (2015). Arzneistoff-Profile (in German). Vol. 9 (28 ed.). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
{{cite book}}: CS1 maint: unrecognized language (link) - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةNewYorker - ^ "Application Number: 204671Orig1s000: Medical Reviews" (PDF). FDA. November 20, 2013. Archived from the original (PDF) on November 10, 2016.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ أ ب "FDA approves Sovaldi for chronic hepatitis C". FDA New Release. U.S. Food and Drug Administration. 2013-12-06. Archived from the original on 2013-12-09.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "FDA approves first combination pill to treat hepatitis C". Archived from the original on 2015-05-04.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "Hepatitis C Dilemma: Treat Illness With Interferon Now or Wait? - WSJ". Archived from the original on 2017-06-02.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Herper, Matthew (February 21, 2014). "Gilead's Hepatitis C Pill Takes Off Like A Rocket". Forbes. Archived from the original on August 31, 2017.
{{cite news}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMercury2014 - ^ "FDA Advisory Committee Supports Approval of Gilead's Sofosbuvir for Chronic Hepatitis C Infection". Drugs.com. October 25, 2013.
{{cite web}}: Italic or bold markup not allowed in:|publisher=(help) - ^ "FDA approves Sovaldi for chronic hepatitis C". FDA New Release. U.S. Food and Drug Administration. 2013-12-06.
- ^ West, Stephen. "Gilead Warns After Hepatitis Patient on Heart Drug Dies". Published 21 March 2015.
- ^ Murphy T (November 21, 2011). "Gilead Sciences to buy Pharmasset for $11 billion". Bloomberg Businessweek.
{{cite web}}: Italic or bold markup not allowed in:|publisher=(help) - ^ Asselah T (2014). "Sofosbuvir for the treatment of hepatitis C virus". Expert Opin Pharmacother. 15 (1): 121–30. doi:10.1517/14656566.2014.857656. PMID 24289735.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ "AASLD 2012: Sofosbuvir and daclatasvir dual regimen cures most people with HCV genotypes 1, 2, or 3". News. European Liver Patients Association. 2012-11-21.
- ^ AASLD: PSI-7977 plus Ribavirin Can Cure Hepatitis C in 12 Weeks without Interferon. Highleyman, L. HIVandHepatitis.com. 8 November 2011.
- ^ Gane EJ, Stedman CA, Hyland RH, Ding X, Svarovskaia E, Symonds WT, Hindes RG, Berrey MM (2013). "Nucleotide polymerase inhibitor sofosbuvir plus ribavirin for hepatitis C". N. Engl. J. Med. 368 (1): 34–44. doi:10.1056/NEJMoa1208953. PMID 23281974.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ CROI 2013: Sofosbuvir + Ledipasvir + Ribavirin Combo for HCV Produces 100% Sustained Response. Highleyman, L. HIVandHepatitis.com. 4 March 2013.
- ^ Pollack A (December 6, 2013). "F.D.A. Approves Pill to Treat Hepatitis C". NYTimes.com.
- ^ أ ب ت ث Campbell T (December 11, 2013). "Gilead's Sofosbuvir Gets New Name, Price, Headaches". The Motley Fool.
- ^ Advocates Protest the Cost of a Hepatitis C Cure, Jon Cohen, Science, 13 December 2013:Vol. 342 no. 6164 pp. 1302-1303 DOI: 10.1126/science.342.6164.1302
- ^ أ ب Kuhrt, Nicola (February 10, 2015). "Hepatitis-Pille Sovaldi: "Ärzte der Welt" geht gegen Patent vor" (in German). Der Spiegel. Archived from the original on February 10, 2015. Retrieved February 10, 2015.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help); Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help)CS1 maint: unrecognized language (link) - ^ Einhorn, Bruce. "How India's Patent Office Destroyed Gilead's Global Game Plan". Bloomberg.com. Archived from the original on 2016-01-01. Retrieved 2015-12-30.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Mezher, Michael (February 4, 2015). "Follow the Rules, Indian Court Tells Patent Office in Sovaldi Case". Regulatory Affairs Professionals Society. Archived from the original on 2016-05-01.
{{cite web}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - ^ Datta, Jyothi (2 February 2015). "More patent-opposition on Gilead's hepatitis C drug, sofosbuvir". Hindu Business Line. Archived from the original on 23 September 2017.
{{cite web}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help); Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "DOCTORS OF THE WORLD—MÉDECINS DU MONDE OPPOSES SOFOSBUVIR PATENT IN EUROPE". Médecins du Monde. Archived from the original on 12 February 2015. Retrieved 12 February 2015.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "European Patent EP2203462, granted 21 May 2014". European Patent Register. European Patent Office. Retrieved 12 February 2015.
- ^ "Conflit autour d'un traitement contre l'hépatite C" (in French). February 10, 2015. Retrieved March 4, 2015.
{{cite web}}: CS1 maint: unrecognized language (link) - ^ "Charity challenges Gilead's European patent on hepatitis C therapy Sovaldi". February 10, 2015. Archived from the original on April 2, 2015. Retrieved March 4, 2015.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "High Cost of Sovaldi Hepatitis C Drug Prompts a Call to Void Its Patents". The New York Times. Archived from the original on 2015-05-23.
{{cite web}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - ^ "More Americans and Chinese Traveling to India for Hepatitis C Treatment". WebMD China. June 3, 2016.
- ^ Childs-Kean LM, Hand EO (February 2015). "Simeprevir and sofosbuvir for treatment of chronic hepatitis C infection". Clinical Therapeutics. 37 (2): 243–67. doi:10.1016/j.clinthera.2014.12.012. PMID 25601269.
- ^ Smith MA, Chan J, Mohammad RA (March 2015). "Ledipasvir-sofosbuvir: interferon-/ribavirin-free regimen for chronic hepatitis C virus infection". The Annals of Pharmacotherapy. 49 (3): 343–50. doi:10.1177/1060028014563952. PMID 25515863. Archived from the original on February 27, 2015.
{{cite journal}}: Unknown parameter|dead-url=ignored (|url-status=suggested) (help) - ^ FDA, News Release (June 28, 2016). "FDA approves Epclusa for treatment of chronic Hepatitis C virus infection". Archived from the original on June 3, 2017.
{{cite journal}}: Cite journal requires|journal=(help); Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Merlot, Julia (November 2, 2017). "Hepatitis C könnte für 50 Dollar geheilt werden" (in German). Der Spiegel. Retrieved November 2, 2017.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help)CS1 maint: unrecognized language (link) - ^ "بعد علاج الإبراشي به.. أول تعليق رسمي على استخدام "سوفالدي" لعلاج كورونا".
- ^ "Comparison of tenofovir prodrugs: TAF vs TDF". DRUG R&D INSIGHT. Archived from the original on 25 November 2015. Retrieved 24 November 2015.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Murakami E, Tolstykh T, Bao H, Niu C, Steuer HM, Bao D, Chang W, Espiritu C, Bansal S, Lam AM, Otto MJ, Sofia MJ, Furman PA (November 2010). "Mechanism of activation of PSI-7851 and its diastereoisomer PSI-7977". The Journal of Biological Chemistry. 285 (45): 34337–47. doi:10.1074/jbc.M110.161802. PMC 2966047. PMID 20801890.
وصلات خارجية
- CS1 errors: unsupported parameter
- CS1 maint: unflagged free DOI
- CS1 errors: markup
- ECHA InfoCard ID from Wikidata
- Pages using infobox drug with unknown parameters
- Articles without EBI source
- Chemical pages without DrugBank identifier
- Articles without KEGG source
- Drugs with no legal status
- Articles containing unverified chemical infoboxes
- Prodrugs
- NS5B (polymerase) inhibitors
- Pyrimidinediones
- Hepatitis C
- فلوريدات عضوية
- علاجات اختراقية
- Specialty drugs
- الأدوية الأساسية حسب منظمة الصحة العالمية
- گلعاد للعلوم
- RTT
- أدوية أولية
- أدوية مضادة لڤروسات الرنا
- التهاب الكبد الڤيروسي سي
- پروپيونات