مناعة القطيع
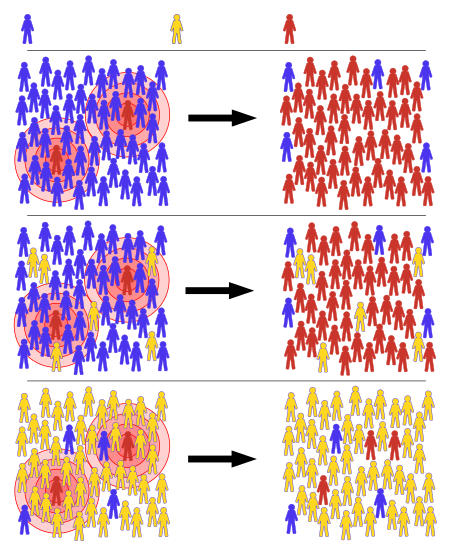
مناعة القطيع Herd immunity (تسمى أيضاً تأثير القطيع، herd effect المناعة المجتمعية community immunity، المناعة السكانية population immunity، أو المناعة الاجتماعية social immunity)، هي أحد أشكال الحماية الغير مباشرة من الأمراض المعدية التي تحدث عندما يصبح لدى نسبة كبيرة من السكان مناعة لعدوى ما، سواء ما كانت مكتسبة من خلال عدوى سابقة أو عن طريق التطعيم، ومن ثم يتوافر قدر من الحماية للأفراد الغير محصنين.[1][2] بين السكان الذين لديهم نسبة كبيرة من الأفراد المحصنين، لديهم مناعة، حيث من غير المرجح أن يسهم هؤلاء الأشخاص في انتقال المرض، من المرجح أن تتعطل سلاسل العدوى، مما يؤدي إلى توقف أو إبطاء انتشار المرض.[3] كلما زادت نسبة الأفراد ذوي المناعة في المجتمع، قل احتمال اتصال الأفراد الذين ليس لديهم مناعة بشخص معدي، مما يساعد على حماية الأفراد ممن ليس لديهم مناعة من العدوى.[1]
يمكن للأفراد أن يصبحوا محصنين من خلال التعافي من عدوى سابقة أو من خلال التطعيم.[3] لا يمكن لبعض الأفراد أن يصبحوا محصنين لأسباب طبية ، مثل نقص المناعة أو كبت المناعة ، وتعد مناعة القطيع في هذه المجموعة طريقة حاسمة للحماية.[4][5] بمجرد الوصول إلى عتبة معينة ، تقضي مناعة القطيع تدريجياً على مرض منتشر بين السكان.[5] قد تؤدي هذه الإزالة ، إذا تم تحقيقها في جميع أنحاء العالم ، إلى انخفاض دائم في عدد العدوى إلى الصفر ، و يسمى ذلك الاستئصال.[6] ساهمت مناعة القطيع التي تم إنشاؤها عن طريق التطعيم في القضاء على الجدري في عام 1977 وساهمت في الحد من تكرر أمراض أخرى.[7]لا تنطبق مناعة القطيع على جميع الأمراض ، فقط تلك المعدية ، وهذا يعني أنها يمكن أن تنتقل من فرد إلى آخر.[5] فالكزاز ، على سبيل المثال ، قابل للانتقال ولكنه ليس معدياً ، لذلك لا تنطبق عليه مناعة القطيع.[4]
تم استخدام مصطلح "مناعة القطيع" لأول مرة في عام 1923.[1] وقد تم الاعتراف بها كظاهرة تحدث بشكل طبيعي في ثلاثينيات القرن العشرين عندما لوحظ أنه بعد أن أصبح عدد كبير من الأطفال محصنين ضد الحصبة ، انخفض عدد الإصابات الجديدة مؤقتًا ، بما في ذلك بين الأطفال المعرضون .[8] أصبح التطعيم الشامل للحث على مناعة القطيع شائعًا منذ ذلك الحين وأثبت نجاحه في منع انتشار العديد من الأمراض المعدية.[9] شكلت معارضة التطعيم تحديًا لمناعة القطيع ، مما سمح باستمرار الأمراض التي يمكن الوقاية منها أو العودة إلى المجتمعات التي لديها معدلات تطعيم غير كافية.[10][11][12]
التأثيرات
حماية من ليس لديهم مناعة

لا يستطيع بعض الأفراد تطوير المناعة بعد التطعيم أو لأسباب طبية لا يمكن تطعيمهم.[14][15][4][14]إن الأطفال حديثي الولادة أصغر من أن يتلقوا العديد من اللقاحات ، إما لأسباب تتعلق بالسلامة أو لأن المناعة السلبية تجعل اللقاح غير فعال.[16]الأفراد الذين يعانون من نقص المناعة بسبب فيروس نقص المناعة البشرية / الإيدز ، سرطان الغدد الليمفاوية ، سرطان الدم ، سرطان النخاع العظمي ، ضعف الطحال ، العلاج الكيميائي ، أو العلاج الإشعاعي ربما فقدوا أي مناعة لديهم سابقًا وقد لا تكون اللقاحات ذات فائدة لهم بسبب نقص المناعة لديهم.[4][14][16][17]
عادة ما تكون اللقاحات غير كاملة ، حيث قد لا تولد أجهزة المناعة لدى الأفراد استجابة مناعية كافية للقاحات لمنح مناعة طويلة المدى ، لذلك قد يفتقر جزء من أولئك الذين تم تطعيمهم إلى مناعة.[1][18][19] أخيرًا ، قد يمنع اللقاح موانع الاستعمال بعض الأفراد من أن يصبحوا محصنين.[14] بالإضافة إلى عدم كونهم محصنين ، قد يكون الأفراد في إحدى هذه المجموعات أكثر عرضة للإصابة بمضاعفات العدوى بسبب حالتهم الطبية ، ولكن قد يبقوا محميين إذا كانت نسبة كبيرة من السكان محصنة.[4][14][19][20]
يمكن لمستويات عالية من الحصانة في فئة عمرية واحدة أن تخلق مناعة قطيع لمجموعات عمرية أخرى.[7] يؤدي تطعيم البالغين ضد السعال الديكي إلى الحد من الإصابة بالسعال الديكي عند الرضع الأصغر سنًا من أن يتم تطعيمهم ، والذين هم الأكثر عرضة لخطر حدوث مضاعفات من المرض.[21][22] هذا مهم بشكل خاص لأفراد الأسرة المقربين ، الذين يمثلون معظم حالات انتقال العدوى إلى الرضع الصغار.[7][19] بالطريقة نفسها ، يقلل الأطفال الذين يتلقون لقاحات ضد المكورات الرئوية من الإصابة بمرض المكورات الرئوية بين الأشقاء الأصغر سناً وغير المحصنين.[23]كان لتطعيم الأطفال ضد المكورات الرئوية والفيروسات العجلية تأثير الحد من التهاب المكورات الرئوية - و الفيروسة العجلية - الاستشفاء المنسوب للأطفال الأكبر سنًا والبالغين ، الذين لا يتلقون هذه اللقاحات بشكل طبيعي.[23][24][25] الإنفلونزا (Flu) أكثر شدة في كبار السن منها في الفئات العمرية الأصغر ، ولكن لقاح الإنفلونزا يفتقر إلى الفعالية في هذه التركيبة السكانية بسبب ضعف الجهاز المناعي مع التقدم في السن.[7][26] تبين أن إعطاء الأطفال في سن المدرسة الأولوية للتحصين ضد الأنفلونزا الموسمية ، وهو أكثر فعالية من تطعيم المسنين ، و يخلق درجة معينة من الحماية للمسنين.[7][26]
بالنسبة لـ العدوى المنقولة جنسياً (STIs) ، فإن المستويات العالية من المناعة في جنس واحد تؤدي إلى مناعة القطيع لكلا الجنسين.[9][27][28]تؤدي اللقاحات ضد الأمراض المنقولة بالاتصال الجنسي التي تستهدف جنس واحد إلى انخفاض كبير في الأمراض المنقولة بالاتصال الجنسي في كلا الجنسين إذا كان أخذ اللقاح في الجنس المستهدف مرتفعًا.[27][28][29] ومع ذلك ، لا تمتد مناعة القطيع من تطعيم الإناث إلى الذكور المثليين.[28]إذا كان أخذ اللقاح بين الجنس المستهدف منخفضًا ، فقد يحتاج الجنس الآخر إلى التحصين حتى يمكن حماية الجنس المستهدف بشكل كاف.[27][28] السلوكيات عالية الخطورة تجعل القضاء على الأمراض المنقولة عن طريق الاتصال الجنسي أمرًا صعبًا لأنه على الرغم من أن معظم حالات العدوى تحدث بين الأفراد ذوي المخاطر المتوسطة ، فإن غالبية حالات الانتقال تحدث بسبب الأفراد الذين يشاركون في السلوكيات عالية المخاطر.[9]لهذه الأسباب ، قد يكون من الضروري في بعض الأفراد تحصين الأشخاص المعرضين لخطر كبير أو الأفراد من كلا الجنسين لتحديد مناعة القطيع.[9][28]
الضغط التطوري
تعمل مناعة القطيع نفسها ك ضغط تطوري على بعض الفيروسات ، مما يؤثر على التطور الفيروسي من خلال تشجيع إنتاج سلالات جديدة ، يشار إليها في هذه الحالة باسم طفرات الهروب ، القادرة على "الهروب" من مناعة القطيع والانتشار بسهولة أكبر.[30][31] على المستوى الجزيئي ، تهرب الفيروسات من مناعة القطيع من خلال الانجراف المستضدي ، وهو عندما تتراكم طفرة في جزء الجينوم الفيروسي الذي يشفر لسطح الفيروس مستضد ، عادة بروتين من الفيروس كاپسيد ، ينتج عنه تغير في الجسم المضاد الفيروسي.[32][33] بدلاً من ذلك ، يمكن أن تؤدي إعادة تصنيف أجزاء الجينوم الفيروسي المنفصلة ، أو التحول المستضدي ، والذي يكون أكثر شيوعًا عندما يكون هناك المزيد من السلالات في الدورة الدموية ، إلى إنتاج نمط مصلي جديد.[30][34] عندما يحدث أي من هذين الأمرين ، لم تعد خلايا الذاكرة التائية قادرة التعرف على الفيروس ، لذا فإن الناس ليسوا محصنين ضد السلالة المتداولة السائدة.[33][34] بالنسبة لكل من الأنفلونزا و نوروڤيروس ، تحفز الأوبئة مؤقتًا مناعة القطيع حتى تظهر سلالة جديدة مهيمنة ، مما يتسبب في موجات متتالية من الأوبئة.[32][34] نظرًا لأن هذا التطور يشكل تحديًا لمناعة القطيع ، فالأجسام المضادة المحايدة على نطاق واسع واللقاحات "الشاملة" التي يمكن أن توفر حماية تتجاوز النمط المصلي المحدد قيد التطوير.[31][35][36]
استبدال النمط المصلي
قد يحدث استبدال النمط المصلي ، أو تغيير النمط المصلي إذا انخفض انتشار نوع مصلي معين بسبب مستويات عالية من المناعة ، مما يسمح للأنماط المصلية الأخرى باستبداله.[37][38] قللت اللقاحات الأولية ضد المكورات العقدية الرئوية بشكل ملحوظ من النقل الأنفي البلعومي للأنماط المصلية للقاح (VTs) ، بما في ذلك أنواع مقاومة للمضادات الحيوية,[23][39] يتم تعويضها بالكامل عن طريق زيادة نقل الأنماط المصلية غير اللقاحية (NVTs) فقط.[23][37][38] هذا لم يؤد إلى زيادة متناسبة في حدوث المرض ، على الرغم من أن NVTs كانت أقل توغلاً من VTs.[37] ومنذ ذلك الحين ، تم إدخال لقاح المكورات الرئوية التي توفر الحماية من الأنماط المصلية الناشئة وقد نجحت في التصدي لظهورها.[23] لا تزال إمكانية التحول في المستقبل ، لذا فإن المزيد من الاستراتيجيات للتعامل مع ذلك تشمل توسيع تغطية VT وتطوير اللقاحات التي تستخدم إما الخلايا الكاملة الميتة ، والتي تحتوي على المزيد من المستضدات السطحية ، أو البروتينات الموجودة في العديد من الأنماط المصلية.[23][40]
القضاء على الأمراض
إذا تم تأسيس مناعة القطيع والمحافظة عليها في مجموعة سكانية لفترة كافية ، فسيتم القضاء على المرض حتمًا - لا يحدث انتقال أكثر للأمراض المتوطنة.[5] إذا تم القضاء على جميع أنحاء العالم وتم تخفيض عدد الحالات بشكل دائم إلى صفر ، فيمكن عندئذ الإعلان عن القضاء على المرض.[6] يمكن اعتبار الاستئصال الأثر النهائي أو النتيجة النهائية لمبادرات الصحة العامة للسيطرة على انتشار الأمراض المعدية.[6][7]
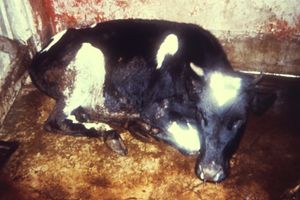
تشمل فوائد الاستئصال إنهاء جميع نسب انتشار المرض والوفيات الناجمة عن المرض ، والادخار المالي للأفراد ، ومقدمي الرعاية الصحية ، والحكومات ، وتمكين الموارد المستخدمة للسيطرة على المرض لاستخدامه في مكان آخر.[6] حتى الآن ، تم القضاء على مرضين باستخدام مناعة القطيع والتحصين هما: طاعون الأبقار و الجدري.[1][7][41] تُبذل حاليًا جهود استئصال تعتمد على مناعة القطيع من أجل شلل الأطفال ، على الرغم من أن الاضطرابات المدنية وانعدام الثقة في الطب الحديث جعل هذا الأمر صعبًا.[1][42] قد يكون التطعيم الإلزامي مفيدًا لجهود الاستئصال إذا لم يكن هناك عدد كاف من الأشخاص الذي اختاروا التطعيم.[43][44][45][46]
الانتقال الحر
مناعة القطيع عرضة لـ مشكلة الانتقال الحر.[47] الأفراد الذين يفتقرون إلى المناعة ، ولا سيما أولئك الذين يختارون عدم التطعيم ، يلتحقون بمناعة القطيع التي أنشأها أولئك الذين يتمتعون بمناعة.[47] مع زيادة عدد المنتقلين الأحرار بين السكان ، تصبح فاشيات الأمراض التي يمكن الوقاية منها أكثر شيوعًا وأكثر حدة بسبب فقدان مناعة القطيع.[10][11][12][44][46] قد يختار الأفراد انتقالاً حراً لمجموعة متنوعة من الأسباب ، بما في ذلك عدم فعالية اللقاح ،[48] معتقدًا أن المخاطر المرتبطة باللقاحات أكبر من تلك المرتبطة بالعدوى,[1][11][12][48] mistrust of vaccines or public health officials,[49] تأثير العربة أو التفكير الجماعي,[44][50] المعايير الاجتماعية أو ضغط الأقران,[48] والمعتقدات الدينية.[11] من المرجح أن يختار بعض الأفراد عدم تلقي اللقاحات إذا كانت معدلات التطعيم عالية بما يكفي لإقناع الشخص بأنه قد لا يحتاج إلى التطعيم ، لأن نسبة كافية من الآخرين لديهم مناعة بالفعل.[1][46]
الآليات
| المرض | الانتقال | R0 | HIT |
|---|---|---|---|
| الحصبة | منقول جواً | 12–18 | 92–95% |
| السعال الديكي | قطرات منقولة جواً (رذاذ) | 12–17[52] | 92–94% |
| الخناق | اللعاب | 6–7 | 83–86% |
| الحصبة الألمانية | قطرات منقولة جواً (رذاذ) | ||
| الجدري | 5–7 | 80–86% | |
| شلل الأطفال | الطريق الهضمي | ||
| النكاف | قطرات منقولة جواً (رذاذ) | 4–7 | 75–86% |
| سارس (2002–2004 تفشي سارس) |
2–5[53] | 50–80% | |
| كوڤيد-19 (2019–20 جائحة كورونا فيرس) |
1.4–3.9[54][55] | 29–74% | |
| إيبولا (وباء فيروس إيبولا في غرب أفريقيا) |
السوائل الجسدية | 1.5–2.5[56] | 33–60% |
| الأنفلونزا (جائحة الأنفلونزا) |
قطرات منقولة جواً (رذاذ) | 1.5–1.8[52] | 33–44% |
يعمل الأفراد الذين لديهم مناعة ضد مرض ما كحاجز في انتشار المرض ، مما يبطئ أو يمنع انتقال المرض إلى الآخرين.[3] يمكن اكتساب مناعة الفرد من خلال عدوى طبيعية أو من خلال وسائل اصطناعية ، مثل التطعيم.[3] عندما تصبح نسبة حرجة من السكان محصنة ، تسمى "عتبة مناعة القطيع" (HIT) أو "مستوى مناعة القطيع" (HIL) ، قد لا يستمر المرض بين السكان ، ويتوقف عن أن يكون مرضاً مستوطناً.[5][30]
يمكن حساب هذه العتبة عن طريق أخذ R0, رقم التكاثر الأساسي ، أو متوسط عدد الإصابات الجديدة التي تسببها كل حالة في مجموعة سكانية حساسة ومتجانسة تمامًا ، أو مختلطة جيدًا ، مما يعني أن كل فرد يمكن أن يتلامس مع كل فرد آخر سريع التأثر في المجموعة,[9][30][43] وضربها في "S" ، وهي نسبة السكان المعرضين للإصابة:
S يمكن إعادة كتابتها (1 - p) لأن p هي نسبة السكان الذين لديهم مناعة وp + S يساوي واحد. بعد ذلك ، يمكن إعادة ترتيب المعادلة لوضع p على حدى على النحو التالي:
- → →
بوضع p على حدى على يسار المعادلة, يمكن كتابتها pc لتمثيل النسبة الحرجة من السكان اللازمة لتصبح محصنة لوقف انتقال المرض ، أو "عتبة مناعة القطيع".[9] R0 يعمل كمقياس للعدوى ،ترتبط قيم R0 المنخفضة جداً بقيم انخفاض HIT, حيث تنتج المعدلات العالية من R0s ارتفاع الإصابات .[30][43]على سبيل المثال ، الإصابة لمرض R0 من 2 نظرياً 50% فقط, بينما مع المرض ب R0 من 10 HIT النظرية 90%.[30]
تفترض هذه الحسابات أن جميع السكان عرضة للإصابة ، مما يعني عدم وجود أفراد محصنين ضد المرض. في الواقع ، فإن نسبًا مختلفة من السكان محصنة ضد أي مرض معين في أي وقت.[9] لحساب هذا ، العدد النكاثري الفعال Re, يمكن كتابته كRt, أو متوسط عدد HIT التي تحدث في الزمن "t" ، يمكن العثور عليه عن طريق ضرب R0 من جزء السكان الذي لا يزال عرضة للإصابة. عندما Re يتم تقليل عدد الحالات التي تحدث في السكان إلى أقل من 1 ويستمر إلى انخفاضها تدريجيًا حتى يتم القضاء على المرض.[9][30][57] إذا كان السكان محصنين ضد مرض يزيد عن HIT لهذا المرض ، فإن عدد الحالات ينخفض بمعدل أسرع ، ويقل احتمال حدوث الفاشيات ، وتكون الفاشيات التي تحدث أقل مما يمكن أن يحدث خلاف ذلك.[1][9] إذا كان Re زائداً عن 1 ، ثم لا يكون المرض في حالة ثابتة ولا ينقص في الإصابة ، ولكنه ينتشر بنشاط بين السكان ويصيب عددًا أكبر من الناس من المعتاد.[44][57]
الافتراض الثاني في هذه الحسابات هو أن السكان متجانسون ، أو مختلطون جيدًا ، مما يعني أن كل فرد على اتصال مع كل فرد آخر ، عندما يتم وصف السكان بشكل أفضل على أنه شبكات اجتماعية حيث يميل الأفراد إلى التجمع معًا ، ويبقون قريبين نسبيًا التواصل مع عدد محدود من الأفراد الآخرين. في هذه الشبكات ، يحدث الإنتقال فقط بين من هم قريبون جغرافياً أو مادياً من بعضهم البعض.[1][43][44] من المرجح أن يغير شكل وحجم الشبكة من HIT المرض ، مما يجعل الإصابة إما أكثر أو أقل شيوعًا.[30][43]
في التجمعات غير المتجانسة, R0 يعتبر الآن مقياسًا لعدد الحالات الناتجة عن شخص معدي "نموذجي" ، والذي يعتمد على كيفية تفاعل الأفراد داخل الشبكة مع بعضهم البعض.[1] تكون التفاعلات داخل الشبكات أكثر شيوعًا من الشبكات ، وفي هذه الحالة تنقل أكثر الشبكات اتصالًا بالمرض بسهولة أكبر ، مما يؤدي إلى ارتفاع R0 و HIT أعلى مما هو مطلوب في شبكة أقل اتصالاً.[1][44] في الشبكات التي تختار إما عدم التحصين ضد المرض أو لا يتم تحصينها بشكل كافٍ ، قد تستمر الأمراض على الرغم من عدم وجودها في الشبكات المحصنة بشكل أفضل.[44]
التعزيزات
اللقاح
الطريقة الأساسية لزيادة مستويات المناعة لدى السكان هي من خلال اللقاح.[1][58] يعتمد التطعيم في الأصل على ملاحظة أن عاملات المحالب المعرضات لـ الجدري كانوا محصنين ضد الجدري ، لذلك بدأت ممارسة التلقيح للأشخاص المصابين بفيروس جدري البقر كوسيلة لمنع الجدري.[42] توفر اللقاحات المتطورة الحماية بطريقة أكثر أمانًا بكثير من الالتهابات الطبيعية ، حيث لا تسبب اللقاحات بشكل عام الأمراض التي تحميها والآثار السلبية الشديدة أقل شيوعًا بشكل كبير من المضاعفات الناتجة عن العدوى الطبيعية.[59][60]
لا يميز الجهاز المناعي بين الالتهابات الطبيعية واللقاحات ، وتشكل استجابة نشطة لكليهما ، لذا فإن المناعة المستحثة عن طريق التطعيم مشابهة لما كان سيحدث من الالتقاط و يتعافى من المرض.[61] لتحقيق مناعة القطيع من خلال التطعيم ، يهدف مصنعو اللقاحات إلى إنتاج لقاحات ذات معدلات خطأ منخفضة و تهدف صناع السياسات إلى تشجيع استخدامها.[58] بعد الإدخال الناجح للقاح واستخدامه على نطاق واسع ، يمكن ملاحظة حدوث انخفاضات حادة في الإصابة بالأمراض التي يحميها ، مما يقلل بالضرورة من عدد حالات الاستشفاء والوفيات الناجمة عن هذه الأمراض.[62][63][64]
إذا افترضنا أن اللقاح فعال 100٪ ، فإن المعادلة المستخدمة لحساب عتبة مناعة القطيع يمكن استخدامها لحساب مستوى التطعيم المطلوب للقضاء على المرض ، Vc.[1] اللقاحات عادة ما تكون ناقصة ، ومع ذلك فإن فعالية اللقاح , E, يجب احتسابها:
من هذه المعادلة ، يمكن ملاحظة أنه إذا كانتE أقل من (1 − 1/R0), عندها يكون من المستحيل القضاء على المرض ، حتى لو تم تطعيم جميع السكان.[1] وبالمثل ، فإن ضعف المناعة الناجم عن اللقاح ، كما يحدث مع لقاحات السعال الديكي ، يتطلب مستويات أعلى من التطعيم الداعم للحفاظ على مناعة القطيع.[1][21] إذا كان المرض قد توقف عن التوطن بين السكان ، فإن العدوى الطبيعية لم تعد تساهم في انخفاض نسبة السكان المعرضين للإصابة. التطعيم فقط يساهم في هذا الانخفاض.[9] يمكن إظهار العلاقة بين تغطية اللقاح وفعاليته ووقوع المرض بطرح منتج فعالية اللقاح ونسبة السكان الذين تم تطعيمهم ، pv, من معادلة عتبة مناعة القطيع على النحو التالي:
يمكن ملاحظة من هذه المعادلة ، ceteris paribus ، أي زيادة في تغطية اللقاح أو فعالية اللقاح ، بما في ذلك أي زيادة تزيد عن HIT للمرض ، تقلل أيضًا من عدد حالات المرض.[9] معدل الانخفاض في الحالات يعتمد على R0 المرض, مع انخفاض قيم المرضR0 التي تعاني من انخفاضات أكثر حدة.[9] عادة ما تحتوي اللقاحات على موانع واحدة على الأقل لمجموعة معينة من السكان لأسباب طبية ، ولكن إذا كانت الفعالية والتغطية عالية بما يكفي من المناعة يمكن أن تحمي هؤلاء الأفراد.[15][17][20] غالبًا ما تتأثر فعالية اللقاح سلبًا بالمناعة السلبية,[65][66]لذا ينصح بجرعات إضافية لبعض اللقاحات بينما لا يتم إعطاء البعض الآخر حتى بعد أن يفقد الفرد مناعته السلبية.[16][20]
المناعة السلبية
يمكن أيضًا اكتساب المناعة الفردية بشكل سلبي ، حيث يتم نقل الأجسام المضادة إلى العامل الممرض من فرد إلى آخر. يمكن أن يحدث هذا بشكل طبيعي ، حيث يتم نقل الأجسام المضادة للأمهات ، بشكل رئيسي الأجسام المضادة چلوبولين مناعي G ، عبر المشيمة وفي اللبأ إلى الأجنة وحديثي الولادة,[67][68] أو بشكل مصطنع ، يتم من خلاله حقن الأجسام المضادة من مصل أو بلازما لفرد لديه مناعة في شخص عرضة للمرض.[61][69] تكون الحماية المتولدة من الحصانة السلبية فورية ولكنها تتلاشى على مدى أسابيع إلى شهور ، لذا فإن أي مساهمة في مناعة القطيع مؤقتة.[5][61][70] بالنسبة للأمراض الشديدة بشكل خاص بين الأجنة وحديثي الولادة ، مثل الأنفلونزا والكزاز ، يمكن تحصين النساء الحوامل من أجل نقل الأجسام المضادة إلى الطفل.[15][71][72] بالطريقة نفسها ، قد تتلقى المجموعات المعرضة لخطورة عالية والتي من المرجح أن تتعرض للعدوى أو أكثر عرضة للإصابة بمضاعفات من العدوى مستحضرات الجسم المضاد لمنع هذه العدوى أو لتقليل شدة الأعراض.[69]
تحليل التكلفة-الفائدة
غالبًا ما يتم حساب مناعة القطيع عند إجراء تحليلات التكلفة والفائدة من برامج التطعيم. يعتبر المؤثر الخارجي الإيجابي من مستويات عالية من المناعة ، مما ينتج فائدة إضافية من الحد من الأمراض التي لن تحدث لو لم يتم توليد مناعة القطيع في السكان.[73][74] لذلك ، فإن إدراج مناعة القطيع في تحليلات التكلفة والفائدة يؤدي إلى نسب مردودية أكثر فعالية من حيث التكلفة أو التكلفة والفائدة وزيادة في عدد حالات المرض التي يتم تجنبها عن طريق التطعيم.[74] تشمل تصميمات الدراسة التي تم إجراؤها لتقدير فائدة مناعة القطيع تسجيل حالات الإصابة بالمرض في الأسر التي تم فيها تطعيم العضو ، وعشوائية السكان في منطقة جغرافية واحدة ليتم تطعيمها أم لا ، ومراقبة حدوث المرض قبل وبعد إدخال برنامج التطعيم.[75] من هذه ، يمكن ملاحظة أن الإصابة بالمرض قد تنخفض إلى مستوى يتجاوز ما يمكن توقعه من الحماية المباشرة وحدها ، مما يشير إلى أن مناعة القطيع ساهمت في تخفيض الإصابات.[75]عندما يتم حساب استبدال النمط المصلي ، فإنه يقلل من الفوائد المتوقعة للتطعيم.[74]
التاريخ
.]]
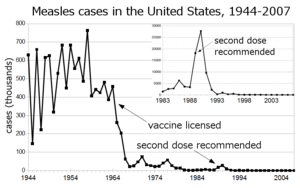
تم استخدام مصطلح "مناعة القطيع" لأول مرة في عام 1923 للإشارة إلى مناعة السكان بأكملها ، في إشارة إلى بحث فحص وفيات الأمراض لدى الفأر للسكان بدرجات متفاوتة من المناعة.[76]تم التعرف على مناعة القطيع لأول مرة كظاهرة تحدث بشكل طبيعي في ثلاثينيات القرن العشرين عندما نشر AW Hedrich بحثًا عن وبائيات الحصبة في بالتيمور ولاحظ أنه بعد أن أصبح العديد من الأطفال محصنين ضد الحصبة ، فإن عدد الأطفال الجدد انخفضت العدوى مؤقتًا ، بما في ذلك بين الأطفال المعرضين للإصابة.[8] على الرغم من هذه المعرفة ، لم تنجح الجهود المبذولة للسيطرة على الحصبة والقضاء عليها حتى بدأ التطعيم الشامل باستخدام لقاح الحصبة في الستينيات.[8] أدى التطعيم الجماعي ومناقشات استئصال المرض وتحليلات التكلفة والفائدة للتطعيم إلى استخدام مصطلح "مناعة القطيع" على نطاق أوسع.[1] في السبعينيات ، تم تطوير النظرية المستخدمة لحساب عتبة مناعة القطيع للمرض.[1] Dخلال حملة استئصال الجدري في الستينيات والسبعينيات ، بدأت ممارسة التطعيم الدائري ، التي تعتبر مناعة القطيع جزءًا لا يتجزأ منها ، كوسيلة لتحصين كل شخص في "حلقة" حول شخص مصاب لمنع تفشي المرض.[77]
منذ اعتماد التطعيم الشامل والحلقي ، ظهرت تعقيدات وتحديات لمناعة القطيع.[1][58] وضعت نمذجة انتشار الأمراض المعدية في الأصل عددًا من الافتراضات ، وهي أن مجموعات سكانية بأكملها عرضة للإصابة و هي مختلطة جيدًا ، وهي غير موجودة في الواقع ، لذلك تم تطوير معادلات أكثر دقة.[1] في العقود الأخيرة ، تم الاعتراف بأن السلالة السائدة للكائنات الحية الدقيقة المتداولة قد تتغير بسبب مناعة القطيع ، إما بسبب مناعة القطيع كضغط تطوري أو لأن مناعة القطيع ضد سلالة واحدة سمحت لسلالة أخرى موجودة بالفعل بالانتشار.[32][38] أدت خلافات اللقاحات الناشئة أو المستمرة وأسباب مختلفة لمعارضة التطعيم إلى خفض مناعة القطيع أو القضاء عليها في مجتمعات معينة ، مما سمح باستمرار الأمراض التي يمكن الوقاية منها أو العودة إليها.[10][11][12]
انظر أيضاً
المصادر
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف Fine, P.; Eames, K.; Heymann, D. L. (1 April 2011). "'Herd immunity': A rough guide". Clinical Infectious Diseases. 52 (7): 911–16. doi:10.1093/cid/cir007. PMID 21427399.
- ^ Gordis, L. (14 November 2013). Epidemiology. Elsevier Health Sciences. pp. 26–27. ISBN 978-1455742516. Retrieved 29 March 2015.
- ^ أ ب ت ث Merrill, R. M. (2013). Introduction to Epidemiology. Jones & Bartlett Publishers. pp. 68–71. ISBN 978-1449645175. Retrieved 29 March 2015.
- ^ أ ب ت ث ج "Herd Immunity". Oxford Vaccine Group, University of Oxford. Retrieved 12 December 2017.
- ^ أ ب ت ث ج ح Somerville, M.; Kumaran, K.; Anderson, R. (19 January 2012). Public Health and Epidemiology at a Glance. John Wiley & Sons. pp. 58–59. ISBN 978-1118308646. Retrieved 29 March 2015.
- ^ أ ب ت ث Cliff, A.; Smallman-Raynor, M. (11 April 2013). Oxford Textbook of Infectious Disease Control: A Geographical Analysis from Medieval Quarantine to Global Eradication. Oxford University Press. pp. 125–36. ISBN 978-0199596614. Retrieved 29 March 2015.
- ^ أ ب ت ث ج ح خ Kim, T. H.; Jonhstone, J.; Loeb, M. (September 2011). "Vaccine herd effect". Scandinavian Journal of Infectious Diseases. 43 (9): 683–89. doi:10.3109/00365548.2011.582247. PMC 3171704. PMID 21604922.
- ^ أ ب ت *Hinman, A. R.; Orenstein, W. A.; Papania, M. J. (1 May 2004). "Evolution of measles elimination strategies in the United States". The Journal of Infectious Diseases. 189 (Suppl 1): S17–22. doi:10.1086/377694. PMID 15106084.
*Sencer, D. J.; Dull, H. B.; Langmuir, A. D. (March 1967). "Epidemiologic basis for eradication of measles in 1967". Public Health Reports. 82 (3): 253–56. doi:10.2307/4592985. JSTOR 4592985. PMC 1919891. PMID 4960501. - ^ أ ب ت ث ج ح خ د ذ ر ز س Garnett, G. P. (1 February 2005). "Role of Herd Immunity in Determining the Effect of Vaccines against Sexually Transmitted Disease". The Journal of Infectious Diseases. 191 (Suppl 1): S97–106. doi:10.1086/425271. PMID 15627236.
- ^ أ ب ت Quadri-Sheriff, M.; Hendrix, K. S.; Downs, S. M.; Sturm, L. A.; Zimet, G. D.; Finnell, S. M. (September 2012). "The role of herd immunity in parents' decision to vaccinate children: a systematic review". Pediatrics. 130 (3): 522–30. doi:10.1542/peds.2012-0140. PMID 22926181.
- ^ أ ب ت ث ج Dubé, E.; Laberge, C.; Guay, M.; Bramadat, P.; Roy, R.; Bettinger, J. (August 2013). "Vaccine hesitancy: an overview". Human Vaccines & Immunotherapeutics. 9 (8): 1763–73. doi:10.4161/hv.24657. PMC 3906279. PMID 23584253.
- ^ أ ب ت ث Ropeik, D. (August 2013). "How society should respond to the risk of vaccine rejection". Human Vaccines & Immunotherapeutics. 9 (8): 1815–18. doi:10.4161/hv.25250. PMC 3906287. PMID 23807359.
- ^ Wane, Joanna. "The case for vaccination" (PDF). North & South. Bauer Media. Archived from the original (PDF) on 24 August 2015. Retrieved 3 July 2015.
- ^ أ ب ت ث ج "Guidelines on vaccinations in paediatric haematology and oncology patients". Biomed Res. Int. 2014: 707691. 2014. doi:10.1155/2014/707691. PMC 4020520. PMID 24868544.
{{cite journal}}: Cite uses deprecated parameter|authors=(help)CS1 maint: unflagged free DOI (link) - ^ أ ب ت Munoz, F. M. (2013). "Maternal immunization: An update for pediatricians". Pediatric Annals. 42 (8): 153–58. doi:10.3928/00904481-20130723-09. PMID 23910028.
- ^ أ ب ت National Center for Immunization and Respiratory Diseases (2011). "General recommendations on immunization – recommendations of the Advisory Committee on Immunization Practices (ACIP)". MMWR. Recommendations and Reports / Centers for Disease Control. 60 (2): 1–64. PMID 21293327.
- ^ أ ب Wolfe, R. M. (2012). "Update on adult immunizations". The Journal of the American Board of Family Medicine. 25 (4): 496–510. doi:10.3122/jabfm.2012.04.100274. PMID 22773718.
- ^ Esposito, S; Bosis, S; Morlacchi, L; Baggi, E; Sabatini, C; Principi, N (2012). "Can infants be protected by means of maternal vaccination?". Clinical Microbiology and Infection. 18 Suppl 5: 85–92. doi:10.1111/j.1469-0691.2012.03936.x. PMID 22862749.
- ^ أ ب ت Rakel, D.; Rakel, R. E. (2015). Textbook of Family Medicine. Elsevier Health Sciences. pp. 99, 187. ISBN 978-0323313087. Retrieved 30 March 2015.
- ^ أ ب ت Tulchinsky, T. H.; Varavikova, E. A. (26 March 2014). The New Public Health: An Introduction for the 21st Century. Academic Press. pp. 163–82. ISBN 978-0124157675. Retrieved 30 March 2015.
- ^ أ ب McGirr, A; Fisman, D. N. (2015). "Duration of Pertussis Immunity After DTaP Immunization: A Meta-analysis". Pediatrics. 135 (2): 331–43. doi:10.1542/peds.2014-1729. PMID 25560446.
- ^ Zepp, F; Heininger, U; Mertsola, J; Bernatowska, E; Guiso, N; Roord, J; Tozzi, A. E.; Van Damme, P (2011). "Rationale for pertussis booster vaccination throughout life in Europe". The Lancet Infectious Diseases. 11 (7): 557–70. doi:10.1016/S1473-3099(11)70007-X. PMID 21600850.
- ^ أ ب ت ث ج ح Pittet, L. F.; Posfay-Barbe, K. M. (2012). "Pneumococcal vaccines for children: A global public health priority". Clinical Microbiology and Infection. 18 Suppl 5: 25–36. doi:10.1111/j.1469-0691.2012.03938.x. PMID 22862432.
- ^ Nakagomi, O; Iturriza-Gomara, M; Nakagomi, T; Cunliffe, N. A. (2013). "Incorporation of a rotavirus vaccine into the national immunisation schedule in the United Kingdom: A review". Expert Opinion on Biological Therapy. 13 (11): 1613–21. doi:10.1517/14712598.2013.840285. PMID 24088009.
- ^ Lopman, B. A.; Payne, D. C.; Tate, J. E.; Patel, M. M.; Cortese, M. M.; Parashar, U. D. (2012). "Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011". Current Opinion in Virology. 2 (4): 434–42. doi:10.1016/j.coviro.2012.05.002. PMID 22749491.
- ^ أ ب Kim, T. H. (2014). "Seasonal influenza and vaccine herd effect". Clinical and Experimental Vaccine Research. 3 (2): 128–32. doi:10.7774/cevr.2014.3.2.128. PMC 4083064. PMID 25003085.
- ^ أ ب ت Lowy, D. R.; Schiller, J. T. (2012). "Reducing HPV-associated cancer globally". Cancer Prevention Research. 5 (1): 18–23. doi:10.1158/1940-6207.CAPR-11-0542. PMC 3285475. PMID 22219162.
- ^ أ ب ت ث ج Lenzi, A; Mirone, V; Gentile, V; Bartoletti, R; Ficarra, V; Foresta, C; Mariani, L; Mazzoli, S; Parisi, S. G.; Perino, A; Picardo, M; Zotti, C. M. (2013). "Rome Consensus Conference – statement; human papilloma virus diseases in males". BMC Public Health. 13: 117. doi:10.1186/1471-2458-13-117. PMC 3642007. PMID 23391351.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Garland, S. M.; Skinner, S. R.; Brotherton, J. M. (2011). "Adolescent and young adult HPV vaccination in Australia: Achievements and challenges". Preventive Medicine. 53 Suppl 1: S29–35. doi:10.1016/j.ypmed.2011.08.015. PMID 21962468.
- ^ أ ب ت ث ج ح خ د Rodpothong, P; Auewarakul, P (2012). "Viral evolution and transmission effectiveness". World Journal of Virology. 1 (5): 131–34. doi:10.5501/wjv.v1.i5.131. PMC 3782273. PMID 24175217.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Corti, D; Lanzavecchia, A (2013). "Broadly neutralizing antiviral antibodies". Annual Review of Immunology. 31: 705–42. doi:10.1146/annurev-immunol-032712-095916. PMID 23330954.
- ^ أ ب ت Bull, R. A.; White, P. A. (2011). "Mechanisms of GII.4 norovirus evolution". Trends in Microbiology. 19 (5): 233–40. doi:10.1016/j.tim.2011.01.002. PMID 21310617.
- ^ أ ب Ramani, S; Atmar, R. L.; Estes, M. K. (2014). "Epidemiology of human noroviruses and updates on vaccine development". Current Opinion in Gastroenterology. 30 (1): 25–33. doi:10.1097/MOG.0000000000000022. PMC 3955997. PMID 24232370.
- ^ أ ب ت Pleschka, S (2013). "Overview of Influenza Viruses". Swine Influenza. Current Topics in Microbiology and Immunology. Vol. 370. pp. 1–20. doi:10.1007/82_2012_272. ISBN 978-3642368707. PMID 23124938.
- ^ Han, T; Marasco, W. A. (2011). "Structural basis of influenza virus neutralization". Annals of the New York Academy of Sciences. 1217: 178–90. doi:10.1111/j.1749-6632.2010.05829.x. PMC 3062959. PMID 21251008.
- ^ Reperant, L. A.; Rimmelzwaan, G. F.; Osterhaus, A. D. (2014). "Advances in influenza vaccination". F1000Prime Reports. 6: 47. doi:10.12703/p6-47. PMC 4047948. PMID 24991424.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت Weinberger, D. M.; Malley, R; Lipsitch, M (2011). "Serotype replacement in disease after pneumococcal vaccination". The Lancet. 378 (9807): 1962–73. doi:10.1016/S0140-6736(10)62225-8. PMC 3256741. PMID 21492929.
- ^ أ ب ت McEllistrem, M. C.; Nahm, M. H. (2012). "Novel pneumococcal serotypes 6C and 6D: Anomaly or harbinger". Clinical Infectious Diseases. 55 (10): 1379–86. doi:10.1093/cid/cis691. PMC 3478140. PMID 22903767.
- ^ Dagan, R (2009). "Impact of pneumococcal conjugate vaccine on infections caused by antibiotic-resistant Streptococcus pneumoniae". Clinical Microbiology and Infection. 15 Suppl 3: 16–20. doi:10.1111/j.1469-0691.2009.02726.x. PMID 19366365.
- ^ Lynch Jp, 3rd; Zhanel, G. G. (2010). "Streptococcus pneumoniae: Epidemiology and risk factors, evolution of antimicrobial resistance, and impact of vaccines". Current Opinion in Pulmonary Medicine. 16 (3): 217–25. doi:10.1097/MCP.0b013e3283385653. PMID 20375783.
{{cite journal}}: CS1 maint: numeric names: authors list (link) - ^ Njeumi, F; Taylor, W; Diallo, A; Miyagishima, K; Pastoret, P. P.; Vallat, B; Traore, M (2012). "The long journey: A brief review of the eradication of rinderpest". Revue Scientifique et Technique (International Office of Epizootics). 31 (3): 729–46. PMID 23520729.
- ^ أ ب Smith, K. A. (2013). "Smallpox: Can we still learn from the journey to eradication?". The Indian Journal of Medical Research. 137 (5): 895–99. PMC 3734679. PMID 23760373.
- ^ أ ب ت ث ج Perisic, A; Bauch, C. T. (2009). "Social contact networks and disease eradicability under voluntary vaccination". PLoS Computational Biology. 5 (2): e1000280. doi:10.1371/journal.pcbi.1000280. PMC 2625434. PMID 19197342.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث ج ح خ Fu, F; Rosenbloom, D. I.; Wang, L; Nowak, M. A. (2011). "Imitation dynamics of vaccination behaviour on social networks" (PDF). Proceedings of the Royal Society B: Biological Sciences. 278 (1702): 42–49. doi:10.1098/rspb.2010.1107. PMC 2992723. PMID 20667876.
- ^ Wicker, S; Maltezou, H. C. (2014). "Vaccine-preventable diseases in Europe: Where do we stand?". Expert Review of Vaccines. 13 (8): 979–87. doi:10.1586/14760584.2014.933077. PMID 24958075.
- ^ أ ب ت Fukuda, E.; Tanimoto, J. (2014). Impact of Stubborn Individuals on a Spread of Infectious Disease under Voluntary Vaccination Policy. Springer. pp. 1–10. ISBN 978-3319133591. Retrieved 30 March 2015.
- ^ أ ب Barrett, Scott (2014). "Global Public Goods and International Development". Too Global To Fail: The World Bank at the Intersection of National and Global Public Policy in 2025. World Bank Publications. pp. 13–18. ISBN 978-1464803109.
{{cite book}}: Unknown parameter|editors=ignored (|editor=suggested) (help) - ^ أ ب ت Gowda, C; Dempsey, A. F. (2013). "The rise (and fall?) of parental vaccine hesitancy". Human Vaccines & Immunotherapeutics. 9 (8): 1755–62. doi:10.4161/hv.25085. PMC 3906278. PMID 23744504.
- ^ Ozawa, S; Stack, M. L. (2013). "Public trust and vaccine acceptance – international perspectives". Human Vaccines & Immunotherapeutics. 9 (8): 1774–78. doi:10.4161/hv.24961. PMC 3906280. PMID 23733039.
- ^ Parker, A. M.; Vardavas, R; Marcum, C. S.; Gidengil, C. A. (2013). "Conscious consideration of herd immunity in influenza vaccination decisions". American Journal of Preventive Medicine. 45 (1): 118–21. doi:10.1016/j.amepre.2013.02.016. PMC 3694502. PMID 23790997.
- ^ Unless noted, R0 values are from: History and Epidemiology of Global Smallpox Eradication Archived 2017-03-17 at the Wayback Machine From the training course titled "Smallpox: Disease, Prevention, and Intervention". The Centers for Disease Control and Prevention and the World Health Organization. Slide 17. Retrieved 13 March 2015.
- ^ أ ب Biggerstaff, M; Cauchemez, S; Reed, C; Gambhir, M; Finelli, L (2014). "Estimates of the reproduction number for seasonal, pandemic, and zoonotic influenza: A systematic review of the literature". BMC Infectious Diseases. 14: 480. doi:10.1186/1471-2334-14-480. PMC 4169819. PMID 25186370.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Wallinga, J; Teunis, P (2004). "Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures". American Journal of Epidemiology. 160 (6): 509–16. doi:10.1093/aje/kwh255. PMID 15353409.
- ^ Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. (January 2020). "Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia". The New England Journal of Medicine. doi:10.1056/NEJMoa2001316. PMID 31995857.
- ^ Riou J, Althaus CL (January 2020). "Pattern of early human-to-human transmission of Wuhan 2019 novel coronavirus (2019-nCoV), December 2019 to January 2020". Euro Surveillance. 25 (4). doi:10.2807/1560-7917.ES.2020.25.4.2000058. PMC 7001239. PMID 32019669.
- ^ Althaus, C. L. (2014). "Estimating the Reproduction Number of Ebola Virus (EBOV) During the 2014 Outbreak in West Africa". PLoS Currents. 6. doi:10.1371/currents.outbreaks.91afb5e0f279e7f29e7056095255b288. PMC 4169395. PMID 25642364.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Dabbaghian, V.; Mago, V. K. (27 October 2013). Theories and Simulations of Complex Social Systems. Springer. pp. 134–35. ISBN 978-3642391491. Retrieved 29 March 2015.
- ^ أ ب ت Rashid, H; Khandaker, G; Booy, R (2012). "Vaccination and herd immunity: What more do we know?". Current Opinion in Infectious Diseases. 25 (3): 243–49. doi:10.1097/QCO.0b013e328352f727. PMID 22561998.
- ^ Maglione, M. A.; Das, L; Raaen, L; Smith, A; Chari, R; Newberry, S; Shanman, R; Perry, T; Goetz, M. B.; Gidengil, C (2014). "Safety of vaccines used for routine immunization of U.S. Children: A systematic review". Pediatrics. 134 (2): 325–37. doi:10.1542/peds.2014-1079. PMID 25086160.
- ^ Demicheli, V; Rivetti, A; Debalini, M. G.; Di Pietrantonj, C (2012). "Vaccines for measles, mumps and rubella in children". Cochrane Database of Systematic Reviews. Vol. 2. pp. CD004407. doi:10.1002/14651858.CD004407.pub3. PMC 6458016. PMID 22336803.
{{cite book}}:|journal=ignored (help) - ^ أ ب ت Pommerville, J. C. (2 December 2014). Fundamentals of Microbiology: Body Systems Edition. Jones & Bartlett Publishers. pp. 559–63. ISBN 978-1284057102. Retrieved 30 March 2015.
- ^ Papaloukas, O; Giannouli, G; Papaevangelou, V (2014). "Successes and challenges in varicella vaccine". Therapeutic Advances in Vaccines. 2 (2): 39–55. doi:10.1177/2051013613515621. PMC 3991154. PMID 24757524.
- ^ Shann, F (2013). "Nonspecific effects of vaccines and the reduction of mortality in children". Clinical Therapeutics. 35 (2): 109–14. doi:10.1016/j.clinthera.2013.01.007. PMID 23375475.
- ^ Visser, A; Hoosen, A (2012). "Haemophilus influenzae type b conjugate vaccines - a South African perspective". Vaccine. 30 Suppl 3: C52–57. doi:10.1016/j.vaccine.2012.06.022. hdl:2263/20792. PMID 22939022.
- ^ Leuridan, E; Sabbe, M; Van Damme, P (2012). "Measles outbreak in Europe: Susceptibility of infants too young to be immunized". Vaccine. 30 (41): 5905–13. doi:10.1016/j.vaccine.2012.07.035. PMID 22841972.
- ^ Hodgins, D. C.; Shewen, P. E. (2012). "Vaccination of neonates: Problem and issues". Vaccine. 30 (9): 1541–59. doi:10.1016/j.vaccine.2011.12.047. PMID 22189699.
- ^ Chucri, T. M.; Monteiro, J. M.; Lima, A. R.; Salvadori, M. L.; Kfoury Jr, J. R.; Miglino, M. A. (2010). "A review of immune transfer by the placenta". Journal of Reproductive Immunology. 87 (1–2): 14–20. doi:10.1016/j.jri.2010.08.062. PMID 20956021.
- ^ Palmeira, P; Quinello, C; Silveira-Lessa, A. L.; Zago, C. A.; Carneiro-Sampaio, M (2012). "IgG placental transfer in healthy and pathological pregnancies". Clinical and Developmental Immunology. 2012: 1–13. doi:10.1155/2012/985646. PMC 3251916. PMID 22235228.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب Parija, S. C. (10 February 2014). Textbook of Microbiology & Immunology. Elsevier Health Sciences. pp. 88–89. ISBN 978-8131236246. Retrieved 30 March 2015.
- ^ Detels, R.; Gulliford, M.; Karim, Q. A.; Tan, C. C. (1 February 2015). Oxford Textbook of Global Public Health. Oxford University Press. p. 1490. ISBN 978-0199661756. Retrieved 30 March 2015.
- ^ Demicheli, Vittorio; Barale, Antonella; Rivetti, Alessandro (2015-07-06). "Vaccines for women for preventing neonatal tetanus". The Cochrane Database of Systematic Reviews (7): CD002959. doi:10.1002/14651858.CD002959.pub4. ISSN 1469-493X. PMID 26144877.
- ^ Swamy, G. K.; Garcia-Putnam, R (2013). "Vaccine-preventable diseases in pregnancy". American Journal of Perinatology. 30 (2): 89–97. doi:10.1055/s-0032-1331032. PMID 23271378.
- ^ "Valuing vaccination". Proc Natl Acad Sci U S A. 111 (34): 12313–19. 26 August 2014. doi:10.1073/pnas.1400475111. PMC 4151736. PMID 25136129.
{{cite journal}}: Cite uses deprecated parameter|authors=(help) - ^ أ ب ت "Systematic review of studies evaluating the broader economic impact of vaccination in low and middle income countries". BMC Public Health. 12: 878. 16 October 2012. doi:10.1186/1471-2458-12-878. PMC 3532196. PMID 23072714.
{{cite journal}}: Cite uses deprecated parameter|authors=(help)CS1 maint: unflagged free DOI (link) - ^ أ ب "Key issues for estimating the impact and cost-effectiveness of seasonal influenza vaccination strategies". Hum Vaccin Immunother. 9 (4): 834–40. April 2013. doi:10.4161/hv.23637. PMC 3903903. PMID 23357859.
{{cite journal}}: Cite uses deprecated parameter|authors=(help) - ^ Topley, W. W. C.; Wilson, G. S. (May 1923). "The Spread of Bacterial Infection. The Problem of Herd-Immunity". The Journal of Hygiene. 21 (3): 243–249. doi:10.1017/s0022172400031478. PMC 2167341. PMID 20474777.
- ^ Strassburg, M. A. (1982). "The global eradication of smallpox". American Journal of Infection Control. 10 (2): 53–59. doi:10.1016/0196-6553(82)90003-7. PMID 7044193.
وصلات خارجية
- A visual simulation of herd immunity written by Shane Killian and modified by Robert Webb