1، 2-ثنائي كلورو الإيثان
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
1,2-Dichloroethane
| |||
| أسماء أخرى | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.145 | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| الخصائص | |||
| الصيغة الجزيئية | C2H4Cl2 | ||
| كتلة مولية | 98.96 g mol-1 | ||
| المظهر | سائل عديم اللون | ||
| الرائحة | رائحة مميزة، لطيفة شبيهة بالكلوروفورم[2] | ||
| الكثافة | 1.253 گ/سم3، سائل | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 0.87 گ/100 م/ل (20 °س) | ||
| اللزوجة | 0.84 mPa·s عند 20 °س | ||
| البنية | |||
| Dipole moment | 1.80 د | ||
| المخاطر | |||
| خطر رئيسي | سام، قابل للاشتعال، ومسرطن | ||
| توصيف المخاطر | R11 R45 R36/37/38 | ||
| تحذيرات وقائية | S45 S53 | ||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | 13 °C (55 °F; 286 K) | ||
| حدود الانفجار | 6.2%-16%[2] | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LC50 (التركيز الأوسط)
|
3000 ppm (guinea pig, 7 hr) 1000 ppm (rat, 7 hr)[3] | ||
LCLo (المنشورة الأقل)
|
1217 ppm (mouse, 2 hr) 1000 ppm (rat, 4 hr) 3000 ppm (rabbit, 7 hr)[3] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 50 ppm C 100 ppm 200 ppm [5-minute maximum peak in any 3 hours][2] | ||
REL (الموصى به)
|
Ca TWA 1 ppm (4 mg/m3) ST 2 ppm (8 mg/m3)[2] | ||
IDLH (خطر عاجل)
|
Ca [50 ppm][2] | ||
| مركبات ذا علاقة | |||
haloalkanes ذات العلاقة
|
كلوريد الميثيل كلوريد الميثيلين 1,1,1-Trichloroethane | ||
مركـّبات ذات علاقة
|
إيثلين كلورين كلوريد الڤينيل | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
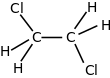
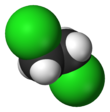
1، 2- ثنائي كلورو الإيثان، وشهرته ثنائي كلوريد الإيثيلين، هو مركب كلور عضوي ينتمي إلى الألكانات الهالوجينية له الصيغة الكيميائية C2H4Cl2، ويكون على شكل سائل عديم اللون.
يختلف هذا المركب عن مصاوغه 1،1-ثنائي كلورو الإيثان أن ذرتي الكلور في الأول مرتبطتين على ذرتي كربون متغايرتين.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
الإنتاج
حضر المركب لأول مرة سنة 1794 من قبل مجموعة من الكيميائيين الهولنديين من خلال تفاعل غازي الإيثين مع الكلور، وأسموه زيت الكيميائيين الهولنديين.[4]
ينتج من المركب حوالي 20 مليون طن في الولايات المتحدة وأوروبا الغربية واليابان؛[5] وذلك من تفاعل غازي الإيثلين والكلور بوجود حفاز من كلوريد الحديد الثلاثي:
أو بتفاعل الكلورة المؤكسَج Oxychlorination بوجود حفاز من كلوريد النحاس الثنائي:
الخواص
يوجد المركب على هيئة سائل زيتي عديم اللون، له رائحة شبيهة برائحة الكلور. وهو ضعيف الامتزاجية مع الماء، والتي تزداد مع ارتفاع درجة الحرارة.
الاستخدامات
يستخدم حوالي 80% من 2،1-ثنائي كلورو الإيثان المنتج في تحضير مركب كلوريد الفاينيل المستخدم في صناعة بوليمير كلوريد متعدد الفاينيل PVC.
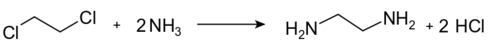
كما يستخدم أيضاً في تحضير مركب ثنائي أمين الإيثيلين وفق التفاعل التالي:
السلامة
المصادر
- ^ Staff writer. "Standard Abbreviations and Acronyms" (PDF). The Journal of Organic Chemistry.
DCE: 1,2-dichloroethane
- ^ أ ب ت ث ج NIOSH Pocket Guide to Chemical Hazards 0271
- ^ أ ب "Ethylene dichloride". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Deimann, van Troostwyk, Bondt and Louwrenburgh (1795) "Ueber die Gasarten, welche man aus Verbindungen von starker Vitriolsäure und Alkohol erhält" (On the types of gases which one obtains from combinations of strong vitriolic acid and alcohol), Chemische Annalen … , 2 : 195-205, 310-316, 430-440. The production and characterization of 1,2-dichloroethane appear on pages 200-202. The investigators were trying to detect the presence of carbon (Kohl) in ethylene (Luft, literally, "air") by adding chlorine (zündend Salzgas, literally, "burning gas from salt"). Instead of the expected soot, an oil (Oehl) formed. Archived 2017-04-23 at the Wayback Machine
- ^ Rev. Environ. Sci. Biotechnol. 3 (3). doi:10.1007/s11157-004-4733-8.
{{cite journal}}: Missing or empty|title=(help); Unknown parameter|last-author-amp=ignored (|name-list-style=suggested) (help); Unknown parameter|السنة=ignored (help); Unknown parameter|الصفحات=ignored (help); Unknown parameter|العنوان=ignored (help); Unknown parameter|المؤلف2=ignored (help); Unknown parameter|المؤلف=ignored (help)
وصلات خارجية
- Gezelschap der Hollandsche Scheikundigen
- ChemicalLand compound database
- Environmental Chemistry compound database
- Merck Chemicals database
- National Pollutant Inventory – 1,2 Dichlorethane Fact Sheet
- Locating and estimating air emissions from sources of ethylene dichloride, EPA report EPA-450/4-84-007d, March 1984
- CS1 errors: unsupported parameter
- CS1 errors: missing title
- Articles with changed EBI identifier
- Articles with changed ChemSpider identifier
- ECHA InfoCard ID from Wikidata
- Articles with changed InChI identifier
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- إضافات الوقود
- كلورو الألكانات
- لدائن
- مبيدات حشرية كلورية عضوية
- مسرطنات المجموعة 2B حسب تصنيف الوكالة الدولية لأبحاث السرطان
- ملوثات الهواء الخطرة