علم الشيخوخة
| د. نبيل عبد القادر ساهم بشكل رئيسي في تحرير هذا المقال
|
| علم الاجتماع |
|---|
| بوابة |
| النظريات والتاريخ |
| مناهج البحث |
| الموضوعات والحقول الفرعية |
علم الشيخوخة Gerontology، هو دراسة الجوانب الاجتماعية والنفسية والحيوية للشيخوخة. The field is distinguished from geriatrics, which is the branch of medicine that specializes in the treatment of existing disease in older adults. Gerontologists include researchers and practitioners in the fields of biology, nursing, medicine, criminology, dentistry, social work, physical and occupational therapy, psychology, psychiatry, sociology, economics, political science, architecture, geography, pharmacy, public health, housing, and anthropology.[1]
ويشمل علم الشيخوخة على ما يلي:
- دراسة التغيرات البدنية، العقلية، والاجتماعية التي تظهر بمرور العمر.
- دراسة عملية الشيخوخة ذاتها (علم الشيخوخة الحيوية)
- دراسة مظاهر الشيخوخة الطبيعية والأمراض المرتبطة بالعمر (geroscience)
- دراسة تأثيرات شيخوخة السكان على المجتمع.
- تطبيق هذه المعارف على السياسة والبرامج، including the macroscopic (for example government planning) and microscopic (for example running a nursing home) perspectives.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
علم الشيخوخة الحيوي
علم الشيخوخة الطبي
علم الشيخوخة الاجتماعي
العمل الاجتماعي مع كبار السن
الانتشار
تاريخ علم الشيخوخة
تجارب معاصرة
عندما تستمع إلى <R.M.روز> (وهو من علماء البيولوجيا التطورية في جامعة كاليفورنيا بمدينة إيرڤن)تشعر كأنه أب فخور يزهو بأبنائه وهو يتحدث عن حشرات ذبابة الفاكهة الرائعة التي قام بتربيتها. فقد استطاع، عن طريق الإكثار المتتابع لذكور وإناث أعمارها آخذة في الازدياد جيلا بعد جيل، أن يحصل على رصيد هائل من حشرة ذبابة الفاكهة دروسوفيلا ميلانوگاستر Drosophila melanogaster التي يقول عنها: إنها تستطيع أن تعيش نحو ضعف المدة التي تعيشها مثيلاتها العادية التي تربى في المختبرات. وطول العمر ليس إلا إحدى السمات المميزة لهذه المتوشالحات(1) Methuselahs الدقيقة. وهي ـ كما يتفاخر روز ـ «ذبابات فائقة، تتميز طيلة عمرها بأنها أصلب عودا وأقدر على مقاومة الظروف الصعبة.» وحتى عندما تتقدم في العمر، يكون الكثير منها أقوى من مثيلاته العادية صغيرة العمر.[2]
وروز له كل الحق في هذا الشعور بالسعادة. فإطالة العمر إطالة كبيرة مع الصحة الجيدة، في أي نوع من أنواع الكائنات الحية، يعد إنجازا عظيما. وفضلا عن ذلك، فإنه بإنماء أعداد كبيرة من ذباب يفوق المعتاد في قوته، صار روز ومساعدوه قادرين على أن يبدؤوا الآن في تعرف الألّيلات (البدائل) alleles، أو الجينات المغايرة، التي قد تكون مسؤولة عن الاختلافات بين هذه الحشرات الفائقة (السوپر) superflies وأقرانها المتواضعة. وقد سبق أن حُدِّد أحد هذه الأليلات تحديدا دقيقا.
وتعد أعمال روز عن ذبابة الفاكهة جزءا من جهود أوسع تهدف إلى تفسير لماذا يشيخ البشر ـ أي لماذا يكون حتما علينا أن نتدهور ونموت. وتشجع إنجازاته، إضافة إلى إنجازات أخرى حديثة في فروع علمية أخرى عديدة، على التفاؤل بأن السؤال الذي كان عصيا على الاختراق في وقت ما، صار يخضع للبحث والتحليل. وكما يقول<R.H.وارنر>، (من المعهد القومي للشيخوخة): «إننا مازلنا نتلمس الطريق، ولكن في غرفة خافتة الضوء بدلا من غرفة معتمة تماما.»
ويقول عدد من العلماء المشاركين في هذا العمل إنهم يأملون في أن تسفر محاولاتهم عن طرق لإبطاء ما يعتقدون أنه عملية شيخوخة يُتحكم فيها داخليا ـ عملية سوف تؤدي في النهاية إلى الموت حتى في غياب الحوادث والعنف والخمج(2) (العدوى) infection. فإذا ما كانت هذه العملية الداخلية موجودة فعلا وأمكن إبطاؤها، فإن هذا الإنجاز سوف يساعد في تأخير أو منع الكثير من أمراض السرطان والقلب وغيرها من العوامل المُعَجِّزة والمميتة التي تزداد احتمالات إصابة البالغين بها مع تقدمهم في العمر.
ومن المؤكد أن أي علاج يؤخر الشيخوخة سيعمل ضمنا على إطالة الحياة، على الرغم من أن قليلا من العلماء يبدون راغبين في قبول أن فكرة إطالة الحياة لها أولوية في حد ذاتها. ويقول <M.S.چازونسكي>(من المركز الطبي في جامعة لويزيانا الحكومية بمدينة نيوأورلِيَنْز): «إن الوضع المثالي هو أن تعيش حياة طويلة صحيحة ثم تمضي في عملية انهيار سريع، لتموت وحذاؤك في قدميك، كما يُقال في أفلام رعاة البقر.»
وقد أصبح روز، وغيره من العلماء، أكثر ثقة من أن الفهم الكامل للشيخوخة بات وشيكا. فيقول روز: «لقد رأينا مدى سهولة تأخير الشيخوخة في الثمانينات فقط، وهذا ما يجعل المجال الآن مثيرا جدا ـ إننا نعمل بمسائل يمكن تطبيقها.» وفي الحقيقة كانت معظم البيانات المتاحة إلى عهد قريب جدا، أي منذ خمسة عشر عاما، وصفية. وكان الاستثناء الملحوظ هو الدليل على أن التقييد السُّعْري (الحراري) caloric restriction يمكن أن يزيد من أعمار القوارض وكثير من الحيوانات الأخرى. (أما كيف يعمل التقييد الغذائي diet restriction فمازال أمرا غير واضح.) وكانت نظريات الشيخوخة كثيرة شائعة كشيوع حشرات الفاكهة. فإما أن الشيخوخة تنجم عن برمجة للوفاة ذات طبيعة وراثية صارمة، أو عن طريق التلف العشوائي للدنا أو لبعض الإنزيمات المهمة اللازمة لاستمرار الجسم في عمله. كما قد تنجم عن التغيرات في مستوى الهرمونات، أو عن تراجع نشاط جهاز المناعة، أو عن النشاط الدؤوب للجزيئات ذات الفعالية العالية والمتميزة بقدرتها التدميرية الكامنة، وتسمى الأشقاق طليقة الأكسجين (الجذور حرة الأكسجين) oxygen free radicals.
إن هذا الحشد من الآراء دفع<A.كومفورت>، وهو من الرواد في هذا المجال، إلى أن يكتب في عام 1979 أن «دراسة الشيخوخة... قد أصابتها النظريات طيلة تاريخها بغموض مخرِّب.» وحتى اليوم مازال إجماع الآراء بعيد المنال، ولكن الباحثين يتفقون، على وجه العموم، على أنه ليس هناك سبب واحد للشيخوخة. ويشير كثير من الأدلة إلى العديد من العمليات المتوازية، والمتآثرة غالبا، والتي يقع كثير منها تحت سيطرة الوراثة، والتي تتضافر لضمان حدوث التداعي النهائي.
الطبيعة تفقد اهتمامها
يتفق عدد من الباحثين، بمن فيهم روز، على أن فهم العلة في نشوء الشيخوخة شرط ينبغي أن يسبق تحققه كشف الأسس الفيزيولوجية للشيخوخة. ويقول هؤلاء الباحثون: إن نظرية التطور تقدم إطارا ضروريا لمعرفة كيف يعمل الجسم وكيف يتوقف عن العمل ـ ولتعرّف الجينات المعنية بالتحكم في مدة الحياة (العمر) life span. ويقول روز عن البحوث في الشيخوخة بوجه عام: «إن الكيمياء الحيوية لها دور قيم فيما نقوم به من عمل، ولكنها لا تقدم أساسا فكريا.»
وتقول النظرية التطورية الأساسية بأن أكثر الأفراد لياقة ـ أي الذين يؤهلهم خليطهم الخاص من الأليلات لأن يكونوا أصلح للبقاء والإنجاب في بيئتهم ـ هم القادرون على إحداث أعظم الأثر في المعين الجيني(3) gene pool للأجيال القادمة. وسوف يتم اصطفاء(4) selection التغيرات الوراثية التي تقوي اللياقة (الصلاحية) fitness (كتلك التي تعمل على تمكين الفرد من أن يكون أسرع فرارا من الخطر) ومن ثم تُستبقى لتصبح شائعة بعد بضعة أجيال. وتُنتخب هذه السمات الوراثية لأن من المحتمل أكثر بقاء حامليها ووفرة ذراريهم، وبذا يسهمون بأعداد كبيرة من أبنائهم للجيل التالي. وبالمثل، سوف يستبعد الاصطفاء الطبيعي الطفرات التي تؤدي إلى الموت الحتمي قبل أن يتم النضج الجنسي. وهكذا لن يخلف الأفراد المصابون بتلك الطفرات المميتة ذرية تنقلها للأجيال التالية.
ومنذ أواخر العقد الأول من القرن التاسع عشر، أخذ الكثير من العلماء يؤيدون فكرة أن الشيخوخة تولدت من أن التخلص من الكبار يزيد لياقة الأفراد الصغار، ربما عن طريق تقليل استنزاف الموارد المتاحة. ويقترح هذا السيناريو أن الشيخوخة مبرمجة (كامنة) في جينات هدفها الأوحد إتلاف الكائن الحي. ولكن هذا الرأي يفقد الآن مؤيديه، وذلك جزئيا لأن معظم الحيوانات لا تعيش في البرية فترة كافية لكي تعطى الفرصة لتصبح معمَّرة. وفي أثناء معظم تاريخنا البشري، نحن أيضا متنا صغارا. وفي المتوسط، يتوقع الشخص الذي يولد اليوم في مجتمع صناعي أن يعيش نحو 75 عاما، في حين كانت الأعمار خلال معظم تاريخنا أقرب إلى الثلاثين أو الأربعين عاما.
وتقول الفرضيات التطورية البديلة بأن الجينات تتحكم في الشيخوخة ولكن الأليلات غير المرغوب فيها لم تنتخب لهذا الغرض على وجه التحديد. فهذه النظريات تؤكد أن جينات الشيخوخة ـ التي تسمى أحيانا جيرونتوجينات gerontogenes ـ أصبحت مستكنة في الكروموسومات (الصبغيات) البشرية لأن الاصطفاء الطبيعي لم يستطع منع انتشارها. فالأليلات المؤذية على وجه التحديد تدوم في نوع من الكائنات إذا لم تكن آثارها الضارة لتظهر إلا بعد بدء التناسل بوقت طويل.
آرومات ليفية (اللون الأزرق) أو خلايا نسيج ضام سوية، مستخلصة من نسيج بشري (في اليسار)، تصبح أكبر حجما كلما نمت لمدة أطول في طبق الزراعة (الاستنبات) (في اليمين). وفي الوقت نفسه، يبطؤ معدل تكاثرها حتى تتوقف الخلايا عن الانقسام في النهاية. وقد استطاع الباحثون في مختبرات عديدة تعرف كثير من الجينات التي يبدو أنها تنظم فقد القدرة على التضاعف. بيد أن ما تفصح عنه هذه النتائج حول كيف يشيخ الجسم ككل فأمر لم يتضح بعد.
بل الأسوأ من ذلك، كما اقترح في الخمسينات<سي.جى وليامز>(من جامعة ولاية نيويورك في ستوني بروك)، أن الأليلات التي تكون مدمرة في الفترة المتأخرة من الحياة سوف يتم تبيُّنها إذا استطاعت، بصورة ما، أن تُظهِر تحسنا في اللياقة مهما كان قدره في مستهل الحياة ـ وهذه ازدواجية تعرف باسم الپليوتروبية(5)(التعددية المظهرية)المتعارضة antagonistic pleiotropy. والجينات التي تحدد التعليمات الخاصة بتخليق هرمونات التناسل يمكن أن تكون من بين تلك المجموعة المخاتلة. ويفترض إس.أوستاد (في جامعة هارڤارد)أن تزايد احتمال الإصابة بسرطان الثدي مع تقدم العمر عند النساء، قد يكون مثالا لهذا: فالتعرض طويل المدى للإستروجين الذي تحتاج إليه النساء للخصوبة يمكن أن يجعل نسيج الثدي عرضة للأورام الخبيثة.
وذلك يشبه ما وجده إى.سى.فنش (في جامعة جنوب كاليفورنيا)من أن مجموعة متنوعة من الهرمونات العادية وغيرها من الجزيئات المنظِّمة قد تضر بالخلايا والأنسجة التي تؤثر فيها. وينظم كل من المهاد التحتاني (ما تحت المهاد)hypothalamus والغدة النخامية pituitary gland وظيفة المبيض، ولكنهما يسهمان أيضا في شيخوخة المبيض في القوارض على الأقل. وفي الوقت نفسه، يبدو أن المبيض ذاته، الذي يبعث بإشارات إلى المهاد التحتاني والغدة النخامية، يُسرِّع من شيخوخة هذين العضوين. ويرى فنش أكثر من ذلك أن الخصائص الپليوتروبية هي دليل على أن الشيخوخة تنشأ، إلى حد ما، عن نشاط الجهاز العصبي وجهاز الغدد الصم وعن التآثرات interactions الحادثة بينهما.
أما الجينات التي تعزز اللياقة المبكرة فليس بالضرورة أن تقوم بتدمير مباشر، في مرحلة متأخرة من الحياة، لكي تسبب التدهور النهائي. وقد اقترح كل من إل.بى.تى.كيركوود (من مجلس البحوث الطبي في لندن)و جى.آر. كتلر (من المعهد القومي للشيخوخة)أن طول العمر يحدث لدى جماعة من السكان إذا ما كانت الأجهزة اللازمة لحفظ الجسم لديهم والتي تخضع للتحكم الوراثي، على درجة كافية من الجودة تضمن للكائن أن يحيا ليُخلِّد النوع وإن كانت عاجزة عن الحفاظ على الجسم إلى الأبد.
الجسد المُستهلَك
يعتقد كيركوود أن معظم الحيوانات لم تُنَمِّ أنظمة حفظ تضمن عدم الفناء، لأن هذا يبدد الطاقة التي يمكن أن توجَّه بشكل أفضل للتكاثر. وحيث إن المخاطر البيئية يمكن أن تقتل الأفراد خلال فترة معقولة يمكن التنبؤ بها، فإن النوع يجب أن يستثمر طاقاته في أنظمة حماية تضمن له حيوية الشباب لهذه المدة المتوقعة وليس أكثر من ذلك. أما باقي مخزون طاقة الكائن فيمكن أن يستغل في زيادة خصوبته.
وعلى نحو ما يحدث في الصناعة من استثمار القليل في إطالة عمر المنتجات التي لن تستخدم إلا لمدة محدودة، يسمي كيركوود نموذجه نظرية الجسد (السُّوما)المُستغنى عنه disposable soma theory. وفي هذه الحالة فإن الخلايا الجسدية somatic cells ـ وهي خلايا الجسم غير التناسلية ـ هي التي يمكن في النهاية أن تُستهلك. وعلى نقيض ذلك، فإن نسبة من الخلايا الجرثومية germ cells لا بد أن تحتفظ بالقدرة على إصلاح نفسها على أفضل وجه وإلا فني النوع.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تغيرات مختارة مما يحدث مع تقدم العمر
بعض من أكثر التغيرات التشريحية والفيزيولوجية الشائعة التي تحدث كلما تقدم الأفراد في العمر مدونة في هذا الجدول. ومما يثير الاهتمام، أن بعض القرود وثدييات أخرى، تشمل القوارض، يحدث لها الكثير من هذه التغيرات.
ويقدر كيركوود أن ما قام به الإنسان من استثمارات في حماية الجسد يقدم قدرة دفاعية كافية لتأكيد القوة والحيوية ربما لأربعين عاما. وهي المدة التي كان من المتوقع لنا أن نعيشها خلال معظم تاريخنا التطوري. وسوف يشمل ذلك الاستثمار بعض القدرة التدعيمية، في حالة التلف العَرَضِيّ. ومن المفترض، أننا نقاوم خلال منتصف الحياة وأواخرها بالاعتماد على احتياطياتنا. وباستنفاد هذا المعين المؤازر تدريجيا نفقد القدرة على الاستجابة للضغوط البيئية، ثم نموت في النهاية.
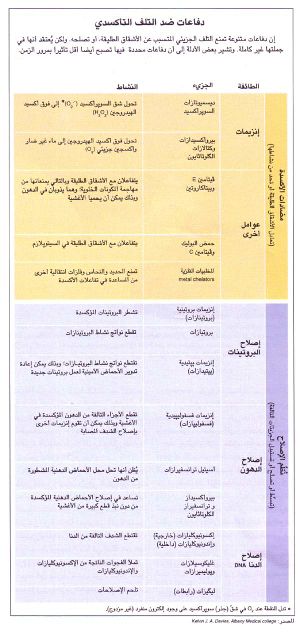
وتقدم نظرية الجسد المستهلك دعما للافتراضات القائلة بأن الشيخوخة تنتج من تلف تسببه الجزيئات الناتجة في مسار الحياة الطبيعي، شاملة الأَشْقاق (الجذور) radicals طليقة الأكسجين. وفكرة أن الأشقاق طليقة الأكسجين تلعب دورا في الشيخوخة قدمها في منتصف الخمسينات دى .هارمان من جامعة نبراسكا. فكثير من التفاعلات البيولوجية يولد أشقاقا طليقة. ولما كانت هذه الأشقاق تحمل إلكترونا منفردا (أي غير مزدوج) فإنها تستطيع أن تؤكسد الدنا DNA والبروتينات والليپيدات وجزيئات أخرى في كل أنحاء الجسم، ومن ثم تتلفها. وهي تستطيع أيضا أن تنتج مزيدا من الأشقاق والمؤكسدات ذات القرابة بها، مثل فوق أكسيد الهيدروجين، وبالتالي تحفز سلاسل طويلة من النشاط التدميري. وقد اقترح هارمان أن تَجمُّع التلف التأكسدي اللاعكوس irreversible في خلايا الجسم وأنسجته قد يسبب الشيخوخة.
ويتسع مفهوم الجسد المستهلَك ليشمل اقتراحا.سيرامي بأن الغلوكوز، مصدر الوقود الرئيسي لجسم الإنسان، يعتبر عاملا رئيسيا آخر في الشيخوخة [انظر: «الغلوكوز وتقدم العمر»، مجلة العلوم ، العدد4(1987)، صفحة15]. وقد أوضح سيرامي (الذي يعمل حاليًا في معهد پيكاور Picower للبحوث الطبية في نيويورك)أن الغلوكوز يغير ببطء البروتينات طويلة الأجل ـ مثل الكولاّجين ـ فيجعلها تترابط بوصلات مستعرضة، فيقيد حركتها. وهو يدعو إلى أن هذه الغليكوسيلية glycosylation (أي ارتباط الغلوكوز بالبروتينات)قد يكون لها دور في التيبس الذي يعتري النسيج الضام وعضلة القلب، مع مرور الوقت.

وتبعا لنموذج الجسد المستهلَك، فإن هذه العمليات وعمليات البِلَى الأخرى يمكن أن تشارك جميعها في الشيخوخة إذا فاقت معدلاتها قدرة نظمنا للحماية والإصلاح الخاصة بمكافحتها. ولكن المحك الحقيقي لهذا الرأي وللفرضيات التطورية الأخرى يكمن في تعرُّف الجينات، وربما المئات منها، التي تتحكم فعلا في الجزيئات التي تحول دون الشيخوخة أو تعجل بحدوثها. وتنشغل مختبرات كثيرة الآن في محاولة عزل (استفراد) بعض من أبعد تلك الجينات أثرا.
دلائل وراثية
قابل كثير من الباحثين ـ ومن بينهم روز و جازونسكي و E.T.جونسون (من جامعة كولورادو) ـ هذا التحدي بالبحث عن الجينات التي يمكن أن تطيل العمر في الكائنات البسيطة نسبيا. ويقول روز «إن الشيخوخة تعد لغزا لا يمكنك فهمه إلا إذا استطعت مقارنة شيخوخة عادية بأخرى مؤجلة، فإن هذا سوف ينبئك بما تفتقده الحيوانات العادية. أما بالنسبة للبشر فإنك لا تجد مجموعات ضابطة.»
وبعد أن كوّن روز ذباب فاكهة شديد التحمل، قارن هو وزملاؤه بين البروتينات التي صنعتها حشرات التجارب والحشرات العادية، وتوصل إلى وجود اختلاف واضح ينتهي إلى أن كثيرا من الذباب طويل العمر ينتج نسخة ذات نشاط يفوق المعتاد من إنزيم ديسميوتاز السوپرأكسيد superoxide dismutase المضاد للأكسدة، ويعني هذا أن هذه الحشرات تحوز صورة مغايرة من الجين الخاص بالإنزيم العادي. وبتخصيص أكثر، إنها أنتجت صورة ذات كفاءة عالية من الإنزيم نفسه الذي يوجد في سيتوپلازم الخلايا. وفي ذباب الفاكهة، كما في الإنسان والكائنات الأخرى، تعمل إنزيمات ديسميوتازات السوپرأكسيد على توقي التلف الذي تسببه الأكسدة، وذلك بالمساعدة في معادلة شقٍّ (جذر) طليق خطر يسمى السوپرأكسيد (الأكسيد الفائق). ويدل هذا التباين الوراثي على أن أحد أسباب الشيخوخة السريعة لذبابة الفاكهة العادية هو أن دفاعاتها المضادة للشق الطلق ليست بفاعلية دفاعات الحشرات التي قاموا بتربيتها لهذا الغرض.
وبالطبع، من المؤكد أن النسخة المغايرة من إنزيم ديسميوتاز السوپرأكسيد، التي أنتجتها ذبابة الفاكهة، ليست إلا عاملا واحدا من العوامل الكثيرة التي تؤثر في سرعة شيخوخة ذلك الذباب. فعلى سبيل المثال، وجد روز و L.J.گريڤزو معاونوهما (في إيرڤن) أن الذباب طويل العمر أكثر مقاومة للتجويع لأنه يختزن دهنا أكثر (ولقد ذكر روز أن هذه الحشرات من القوة بمكان حتى أنها تنثر الدهن في كل الاتجاهات عند لمسها ولو بخفة.) والذباب أيضا غير معرض للجفاف بدرجة كبيرة، ويرجع ذلك جزئيا إلى أنه يختزن كمية كبيرة من مادة الگليكوجين (النشا الحيواني).
ويقول روز «يعد العمل على حشرة الدروسوفيلا تجربة مشجعة لإجراء الشيء نفسه على الفئران. فإننا إذا استطعنا إنتاج فئران طويلة العمر، يمكننا اكتشاف جينات نوعية وإنزيمات وعمليات خلوية لها دور في إطالة العمر.» ولما كانت الفئران من الثدييات فإنها من الناحية الوراثية أقرب من ذبابة الفاكهة إلى الإنسان، ومن ثم فهي جديرة (قمينة) بأن يكون لديها الكثير مما تكشف عنه حول كيف يشيخ البشر. والأرجح أن تكون البحوث في الفئران أكثر ذخرًا بالمعلومات، لو أن شخصا ما قَبِل أن يدفع الفاتورة لأبحاث طويلة المدى، والتي يقدرها روز بنحو عشرة ملايين دولار.

وقد خرجت نتائج تتعلق بعمل روز من مختبر (معمل) جونسون في كولورادو، حيث نجح جونسون وزملاؤه في استخدام التربية بالاصطفاء للحصول على صور مختارة طويلة العمر من دودة دقيقة تعيش في التربة تسمى سينورابديتس إلِگانز(7) Caenorhabditis elegans. وقد نجحوا أيضا في إطالة عمر هذا النوع وذلك بإحداث طفرات وراثية عشوائية.
ويحاول فريق جونسون، كما تفعل مجموعة روز، تعرُّف الجينات التي عبرت عن نفسها تعبيرا متباينا في المجموعة طويلة العمر والمجموعة العادية (أي أنها انتُسخت transcribed، بطريقة متباينة، من الدنا إلى الرنا المِرْسال messenger RNA الذي ترجم بعد ذلك إلى بروتين). وفي عام 1988، قرر جونسون أن طفرة لجين واحد، أسماه age-1، يمكن أن تزيد متوسط العمر للدودة C.elegans بنحو 70%. ومن المدهش أن تلك الديدان الطافرة تنتج مستويات عالية من مضادات المؤكسدات antioxidants (كل من الإنزيم السيتوپلازمي ديسميوتاز السوپرأكسيد وإنزيم كاتالاز catalase)وهي أكثر مقاومة للآثار السامة لمادة پاراكوات paraquat، التي هي مبيد عشبي يتسبب في تولد شقّ السوپرأكسيد (الأكسيد الفائق).
ويبدو أن الطفرة في الجين age-1 تؤدي إلى تثبيط ذلك الجين، وهذا يعني أن البروتين الذي يكوِّد له ما عاد يُصنَّع. فإذا أدى استبعاد البروتين إلى زيادة إنتاج مضادات المؤكسدات فإنه من الجائز أن البروتين العادي يثبط إنتاج هذه المواد.
لماذا يتعمد كائن ما تثبيط اصطناع مثل هذه المركبات المهمة؟ يقول جونسون «لا أعتقد أن هدفه هو قتل الدودة عند عمر معين.» بل إنه، خلافا لذلك، يخمن في أن التثبيط قد يكون تأثيرا غير مرغوب فيه لوظيفة مهمة أخرى لم تُكتشف بعد. وبعبارة أخرى، ربما تكون الپليوتروپية المتعارضة هي التي تعمل.
ويخطط جونسون بأنه فور قيامه باستنسال cloning الجين age-1 ـ وهو يأمل تحقيق ذلك عاجلاً ـ سيبحث عن نظيره في الفئران. فإذا كانت لدى الفئران قطعة مماثلة من الدنا فإن جونسون قد يكون في أثر جين معين ربما له أيضا دور في شيخوخة الإنسان. وجونسون مولع بسطرٍ بعينه من رواية «هكذا تكلم زاراثوسترا» Thus Spoke Zarathustra، لكاتبها <فريدريك نيتشه>: «لقد شققتَ طريقك من الدودة إلى الإنسان، وكثير مما فيك مازال دودة.»وكان يأمل أن تمتد ملاحظات نيتشه حرفيا إلى وراثيات الشيخوخة، وإن كان متأكدا من أن أسباب الشيخوخة في الدودة C.elegans قد تكون مختلفة تماما عن تلك التي في الإنسان.
ولما كان جازونسكي مدركا أن لدينا العديد من الجينات المشتركة حتى مع كائن أدنى من الدودة، من الكائنات وحيدة الخلية، فقد ركز انتباهه على خميرة الخبز (Saccharomyces cerevisiae). وقد تعرَّف جازونسكي العديد من الجينات التي تطيل عمر الخميرة. وأفضل ما درس من تلك الجينات، الجين المعروف بالحروف LAG1 (أي: جين ضمان طول العمر longevity assurance gene 1)، وهو أكثر نشاطا في الخلايا اليافعة عنه في الخلايا المتقدمة في العمر. وتحفيز LAG1 لمزيد من الفعالية في الخلايا المتقدمة في العمر والتي يكون قد تناقص فيها تعبير الجين، يطيل أعمارها بنحو الثلث. والأهم أن خلايا الخميرة كبيرات السن والتي تحمل الجين فائق النشاط لا تصبح خالدة (كما تفعل الخلايا السرطانية في الكائنات عديدة الخلايا)، فلا يعدو الأمر أنها تحيا حياة اليفوع والشباب مدة أطول.
ولا يعرف جازونسكي وظيفة البروتين المقابل، ومع ذلك فقد اكتشف أن جينا مماثلا قد عبر عن نفسه في بعض خلايا الإنسان. وهو الآن يَعزِل الجين البشري ليحدد ما إذا كان يؤثر في عمر أي من الخلايا البشرية. وهو يعتزم أيضا أن يزيد من تعبير جينين آخرين من جينات ضمان (تأمين) طول العمر مع LAG1 حتى يرى ما إذا كانت التأثيرات المشتركة تراكمية أو متآزرة synergetic أو ربما مخرِّبة. وهو يتوقع أن يُقيِّم عدة جينات أخرى، وجد فيها فريقه ما يجعلهم يعتقدون أنها قد تؤثر في طول الأعمار.
اكتشافات جوهرية
ومع أن وظيفة LAG1 مازالت سرا غامضا، فإن اكتشاف أن إنزيم ديسميوتاز السوپرأكسيد يؤثر على ما يبدو في إطالة عمر ذباب روز وديدان جونسون ـ بصورة مثيرة ـ مع التحمس المتزايد لنظرية الأشقاق الطليقة لـ<هارمن>. فقد ذكر جونسون أن النظرية كانت مقبولة منذ 25 عاما على أنها «فرضية مهمة قد تكون صحيحة.» أما الآن فتزايد أعداد الباحثين الذين يؤيدون بصورة جدية احتمال أن تكون الأشقاق الطليقة عاملا مؤثرا حقا في الشيخوخة.
ومازال الكثير من الأدلة المؤيدة للأشقاق الطليقة يعتمد بدرجة أكبر على القرائن والمقارنات، لا على تقديم الأدلة الواضحة المؤسسة على ارتباط المؤثرات بآثارها. فمثلا، إذا كان حدوث تلف بفعل الأشقاق الطليقة لم يتم إصلاحه، سببا من أسباب الشيخوخة، فإن الحيوانات ذات معدل الأيض metabolic rate العالي ـ أي التي تقوم بحرق الأكسجين بدرجة أسرع نسبيا ـ ربما تكون أعمارها أقصر من تلك الأنواع التي يكون استهلاكها للأكسجين أبطأ. وعلى أية حال، فإن ذوات معدل الأيض الأسرع ستكون أيضا أسرع إنتاجا للأشقاق الطليقة. والواقع، إن معدل الأيض القاعدي (الأساسي) ـ أي عند الراحة ـ لنوع ما سيتناسب عكسيا مع متوسط عمره؛ فالفئران، مثلا، معدل أيضها أعلى من معدل أيض البشر، وهي نادرا ما تعيش أكثر من ثلاث سنوات.
وقد كشف كَتْلَر (من المعهد القومي للشيخوخة) عن سند (دعم) آخر. فقد وجد أن نسج البشر والأنواع الأخرى طويلة العمر تنتج إنزيم ديسميوتاز السوپر أكسيد بكمية أكبر على وجه العموم، وهي أكثر مقاومة للأكسدة. ويظن كتلر أن البشر يعمرون جزئيا بسبب أن حمايتهم المتميزة من الأكسدة ليست مع ذلك بكافية لحمايتهم إلى الأبد. ويظن أيضا أن الجزيئات المؤكسجة oxygenated المتفاعلة تسهم في كثير من الاضطرابات الشائعة في أثناء الشيخوخة، وتشمل تصلب الشرايين والسرطان والتهاب المفاصل. إن الدهون المؤكسدة، والتي من المعروف أنها تتراكم في الخلايا التي اعترتها الشيخوخة، لها دخل في العديد من الأمراض.
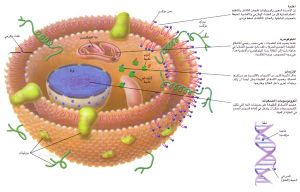
ويأتي أكثر البيانات إقناعا من دراسات الدنا والبروتين. وإلى عهد قريب، كان هناك برهان غير قوي بشكل كاف على أن الدنا يعتريه، بمضي الوقت، تلف غير قابل للإصلاح. فمثلا، معظم الجينات النووية التي دُرست تؤدي إلى صنع بروتينات لها تتابعات صحيحة من الأحماض الأمينية. ويقول<N.B.آمز>(من جامعة كاليفورنيا في بركلي): إن الجينات تفعل ذلك على الرغم من أن الدنا في كل خلية بشرية يتعرض كل يوم لنحو عشرة آلاف «ضربة» أكسدة. ولكن الدراسات الخاصة بدنا الميتوكوندريا mitocondrial DNA تدل على أن تلف الجينات غير القابل للإصلاح يحدث فعلا ـ على الأقل في الميتوكوندريا، وهي العضيات التي تعمل كمحطات قوى خلوية.
وقد بدأ الباحثون في فحص دنا الميتوكوندريا (الذي يحدد نوعية نحو اثني عشر بروتينا لازما لقيام الميتوكوندريا بوظائفها)، دفعهم جزئيا إلى ذلك ما لوحظ من أن قدرة العضيات على توليد الطاقة تقل مع تقدم العمر. فقد ساورهم الشك في أن هجوم الأشقاق الطليقة على الدنا يمكن أن يكون سببا، لأن الميتوكوندريا تعد المصدر الأكبر للأشقاق الطليقة في الجسم، ولأن دنا الميتوكوندريا على وجه الخصوص قابل للتلف التأكسدي. والواقع، إن معدل أكسدة الدنا في الميتوكوندريا أكثر منه في النواة. وتكون المادة الوراثية على الأخص معرضة للتلف لأنه تعوزها البروتينات الهستونية التي ترتبط بالدنا النووي (دنا النواة) وتحميه. هذا فضلا عن أن الجينات الخاصة بالميتوكوندريا، لا تحظى إلا بحد أدنى من حماية الإنزيمات التي وجد <A.J.K.ديڤيز>(من كلية ألباني الطبية)حديثا، أنها تَجُذّ القطع المؤكسدة من الدنا في نواة الخلية، وتُحِلّ مكانها قطعا جديدة.
وقد أبرزت هذه الملاحظات احتمال أن الهجوم المؤكسد الذي لا يلين على دنا الميتوكوندريا يمكن أن يتدخل تدخلا بطيئا في وظائف الميتوكوندريا لدى الأسوياء المتقدمين في السن. وعندما تضار كمية كافية من العضيات ضررا شديدا تصبح الخلايا التي تحويها بحاجة ماسة إلى الطاقة. وعندما يتلف عدد كاف من الخلايا في عضو ما، تضمحل وظيفته.
ويتفق مع هذا المشهد (السيناريو) ما أفاد به<A.G.كورتوپاسي>و<N.أرنهيم>(من جامعة جنوب كاليفورنيا) عام 1990 من أن دنا الميتوكوندريا في خلايا القلب والمخ في كبار السن يحمل عيبا لا يوجد في الأنسجة الجنينية. وطبقا لرأي<C.D.والاس>(من مدرسة إيموري الجامعية الطبية)، يبدو محتملا أن عددا يعتد به من جزيئات دنا الميتوكوندريا قد تكون تالفة في كبار السن. ويخمن والاس أيضا أن بعض الأمراض المزمنة الشائعة في السن المتقدمة قد تكون متعلقة بالفشل الميتوكوندري ويشمل أمراض الداء السكري المتأخر وپاركنسن وألزايمر. ويقول كتلر: «إن المحير أنك مازلت تسأل: أين الدليل على أن هذه التغيرات تحدث أية متاعب؟ فلا تجد الجواب.» بيد أن الباحثين في البروتينات قد يكون عندهم بعض من البرهان الذي يبحث عنه كتلر.
وفي أواخر الثمانينات، استطاع الباحثون تطوير تقنية قياس مجموعات الكربونيل وهي نتاج عادي لأكسدة البروتين. وقد أظهرت القياسات بعد ذلك أن كمية البروتينات المؤكسدة في مختلف أنواع خلايا الإنسان تزداد باطراد ازديادا أسيا exponentially مع تقدم عمر المعطي للمادة المفحوصة. وقد أمكن أيضا الحصول على براهين قاطعة من فحص أروماتٍ ليفيةٍ fibroblasts ـ وهي الخلايا التي تنتج الكولاجين وبعض مكونات النسيج الضام الأخرى ـ مأخوذةٍ من مرضى بعلل وراثية نادرة تسبب الشيخوخة المبكرة. وقد تبين أن الذين يعانون الشُّياخ (البروجيريا) progeria ومتلازمة ڤيرنر Werner's syndrome يظهرون مستويات من مجموعات الكربونيل أعلى كثيرا من تلك الموجودة في الأفراد الأسوياء من العمر نفسه.
وعلى أساس هذه النتائج قدر<R.E.ستادتمان>(من المعهد الوطني للقلب والرئة والدم) أن ما يبلغ نصف البروتينات ـ والتي تتضمن الكثير من الإنزيمات ـ في الأفراد كبار السن، قد تتلف بالأكسدة؛ ومن ثم تصبح عاطلة عن أداء وظائفها. ويضيف ستادتمان: إنه يكاد يكون مؤكدا أن هذه الدرجة من الأكسدة تعمل على ظهور الشيخوخة. ثم يقول بإصرار: «إني أرى أنه من غير المقبول أن نصدق أنه يمكننا أن نفقد 50 في المئة من نشاط إنزيماتنا من دون أن يكون لهذا تأثير ضار في عمليات الأيض.»
وفي عام 1991 قدم<M.J.كارني>ومعاونوه (من مركز كنتكي الطبي)أول دليل مباشر على أن هجوم الأشقاق الطليقة على البروتينات يفسد الوظائف الفيزيولوجية. فهم قد أظهروا أولا أن مستوى البروتين المؤكسد في المخ يزداد مع زيادة عمر الجربيل (العضل)(8) gerbil، وأن معاملته بالمركب المسمى فينيل بيوتيل نيترونphenylbutylnitrone PBN تنقص الأكسدة إلى مستويات الشباب. وبعد ذلك، وفي تجربة لم تتكرر بعد، عالجوا جرابيل هَرِمَة بالمركب PBN لمدة أسبوعين. وقبل المعالجة أجري اختبار على الحيوانات المسنة بوضعها في متاهة(9)، فأسفر الاختبار عن ضعف في الذاكرة قصيرة المدى short-term memory مقارنة بالحيوانات الأصغر سنا. وفي نهاية فترة المعالجة وجد أن الحيوانات المسنة قد أدت اختباراتها في مستوى الحيوانات الأصغر سنا (ولو أن مستوى الأداء قد تدنى بعد ذلك عند عدم الاستمرار في المعالجة).
وقد توصل ستادتمان وآخرون إلى أدلة تثبت أن البروتينات المؤكسدة غير الفعالة تتراكم في الخلايا لأن قدرة الجسم على تحليلها تقل. وقد ذكر ديڤيز أنه قد تبين أن نظم إصلاح خلوية أخرى يبدو أنها تفسد بمضي الوقت أو أنها تصير غير قادرة على الاستجابة بقوة لضغوط الأكسدة. أما حقيقة ما يوهن آلية الإصلاح فمازالت غير معروفة.
وهكذا تدعم بيانات الأشقاق الطليقة احتمال أننا نشيخ بسبب عدم القدرة على الانسجام تماما مع البلى بالاستعمال، وليس لأن كروموسوماتنا مبرمجة لقتلنا. ولكن فكرة وجود برنامج معين يؤدي للوفاة لم تُوَسَّد الثَّرى بعد، بل إن أحد الاتجاهات البارزة في البحث يتفق مع هذا الرأي.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
شيخوخة الخلايا في المختبر
يركز البحث في هذا الاتجاه على استقصاءات في مزارع خلايا بشرية. وكان يعتقد في الخمسينات أن الخلايا البشرية القادرة على التكاثر في الجسم تستطيع أن تتناسخ في المزارع الخلوية بلا نهاية. ولو كان هذا صحيحا لكان يعني أن البشر يشيخون ويموتون ليس بسبب برنامج داخلي لتحلل خلاياهم، ولكن بسبب عمليات تنشأ خارج الخلايا عند مستوى عال من التنظيم الفيزيولوجي.
وقد تداعت هذه المعتقدات عام 1961 عندما قرر L.هايفليك و S. P. مورهيد (اللذان كانا حينذاك في معهد وستار)أن الأرومات الليفية fiberoblasts العادية في الإنسان لها عدد محدد من المرات التي تنقسم فيها. وبصورة أكثر تحديدا، إنها تنقسم عددا مقررا من المرات ـ نحو 50 مرة ـ حيث تستطيع تجمعات من الأرومات الليفية المأخوذة من جنين حديث أن تتضاعف.
ومنذ ذلك الوقت تم التأكد عدة مرات من وجود ما يسمى الآن حد هايفليك Hayflick limit، ومن ثم فإن التحليلات في سبب توقف الخلايا البشرية عن التكاثر في مزارعها، قد تقدم الدليل على انهيار الكائن ككل. «وبفهمنا لماذا تتوقف الخلايا عن التكاثر قد يمكننا فهم بعض الأمور عن الشيخوخة،» هذا ما قاله R.J. سميث (من كلية بايلور الطبية)، ولكنه أضاف قائلا: «إني أعتقد بكل تأكيد أنه سيكون الأمر أكثر صعوبة ـ ربما، على الأقل ألف مرة ـ لفهم الشيخوخة في الفرد السوي من البشر.»
واحتمال أن شيخوخة الخلايا في أوعية المختبر تتعلق بشيخوخة الجسم قد اكتسب دعما من العديد من الاكتشافات. فقد اتضح أن المقدرة على التضاعف تنحدر باطراد مع سن واهبي الخلايا. وبالمثل، فإن الأرومات الليفية من المرضى الذين ابتلوا بمتلازمة ڤيرنر لا تستطيع التناسخ عدد مرات تناسخ خلايا مأخوذة من إنسان عادي في السن نفسه. وكذلك فإن كل طرز الخلايا البشرية التي تمت دراستها حتى الآن ذات حدود خاصة لتكاثرها في مزارع الخلايا.
وقد تعرف الباحثون في بضع السنوات الأخيرة الجينات التي تتغير تأثيراتها بانتظام مع فقدان الأرومات الليفية في المزارع لقدرتها على التضاعف ـ تماما كما هو متوقع فيما لو كان لديها برنامج جيني يؤدي إلى الشيخوخة. ولدى الباحثين برهان على أن جينات في الكروموسومَيْن 1 و 4 تسهم في هذا الفقد لقدرة التضاعف، كما أن J.كمپيسي (التي تعمل حاليا في مختبر لورنس بركلي) قد حددت أن تعطيل الجين c-ƒos يسبق، بل ومن المحتمل أن يؤثر في الكثير من التغيرات الأخرى التي أمكن تعرفها. وعندما يخرس الجين c-ƒos نهائيا تفشل خلايا الأرومات الليفية في مضاعفة حمضها النووي «الدنا»، ومن ثم تفقد قدرتها على الانقسام.
ويشك سميث في أن الجين c-ƒos نفسه قد تهدئه في النهاية عملية أولية إلى حد أبعد. وهو يعبر عن حدسه قائلا: «ما أعتقد أنه يحدث فعلا هو أن الخلايا تنتج مثبطا يوقف بداية تخليق الدنا.» وهو يقول: إنه يظن أنه قد استنسل cloned الجين الخاص بالمثبط، ولذا فإنه سوف يكون قادرا، قريبا جدا، على أن يضع هذه الفكرة موضع الاختبار. ولكنه يعترف بسرعة بأن مفهومه هذا هو واحد من تفسيرات كثيرة ممكنة. «ونحن لم نصل بعد إلى النقطة التي نستطيع عندها فصل السبب عن الأثر، إذ إن نشاط المثبط قد يكون أثرا ثانويا لشيء آخر.»
وأحد احتمالات هذا «الشيء الآخر» هو قِصَر القطع الطرفية telomeres، أي الامتدادات الطويلة من الدنا التي تغطي نهايتي كل كروموسوم وتحميهما من التآكل. وقد وجد B.C .هارلي (من جامعة ماك ماستر في أونتاريو) و W.C.گريدر (من مختبر كولد سبرنگ هاربور)وزملاؤهما أن طول القطع الطرفية يتناقص باطراد في الخلايا الجسدية التي تتضاعف في الجسم، كما أن خلايا الأرومات الليفية في المزارع تتناقص كذلك في أثناء شيخوختها. وفضلا عن ذلك فإن طول القطعة الطرفية ينبئ بقدرة الخلايا على الانقسام أكثر من دلالة سنِّ معطي الخلايا.
ومن المفترض أن القصر يحدث بسبب وجود عيب غريب في الآلية المسؤولة عن تضاعف الدنا في أثناء انقسام الخلية. إنها تزيل جزءا بسيطا من كل نهاية في كل نسخة جديدة تصنعها من الدنا.
وتعني هذه النتائج أن القطع الطرفية يمكن اعتبارها الساعة التي تحدد فقد القدرة التكاثرية للخلايا. ومما يثير الاهتمام أن هارلي و گريدر قررا أن طول القطعة الطرفية يبقى كما هو، بل ربما ازداد زيادة بسيطة في الحيوان المنوي وفي الخلايا المتحولة أو الخالدة التي لا تموت. وهذا البقاء قد يساعدنا في تفسير عدم فقد الخلايا الجرثومية السوية أو الخلايا السرطانية قدرتها على التضاعف.
وهكذا نستطيع أن نقيم الحجة على أن الجسم يتحلل عندما يتحتم أن تفقد الأعضاء قدرتها على تعويض الخلايا التالفة. ومن ناحية أخرى، يرد النقاد بأن الإنسان لا يموت بسبب كف خلايا الأرومات الليفية عن التضاعف، حيث إن الخلايا عادة ما تنقسم انقسامات عديدة عندما يتعرض «مالكها» إلى الفناء. ويشير المتشككون أيضا إلى أن دراسات شيخوخة التضاعف لا يمكن أن تلقي الكثير من الضوء على العمليات المؤدية لتدهور الخلايا التي لا تنقسم، وأبرزها الخلايا العصبية وخلايا عضلة القلب، فهذه الخلايا تعمل عدة سنوات بصورة تدعو للإعجاب.
ومن بين أولئك النقاد نذكر روز الذي يصف العمل في مزارع الخلايا بأنه «جميل تقنيا». ولكنه يصر على أن الباحثين مازالوا في الواقع «يديرون مغازلهم» وأنهم يسبرون probing تكاثر الخلية وحدوده على نحو مفيد، إلا أنه مازال عليهم أن يبينوا أن نتائجهم تكشف أي شيء حول كيفية شيخوخة الإنسان. ويضيف روز: «فلو أن علماء الخلية هؤلاء كانوا يكشفون حقا أي شيء مهم عن شيخوخة الكائنات الحية، لكانوا قادرين على استثمار نتائجهم في تأجيل الشيخوخة، ولكنهم لم يفعلوا ذلك قط، بعد مرور 30 عاما من الدراسة والبحث.»
ويظن سميث أن هذه الانتقادات غير عادلة، وهو يقول: إن التغيرات الوراثية التي شوهدت في خلايا الأرومات الليفية تمثل وجها واحدا فقط من عملية الشيخوخة، ولكن لهذا الوجه الواحد مع ذلك دلالاته الكامنة. وهو يقول: «لعل ما يحدث هو وجود مناطق محلية لا تعمل فيها الخلايا بكفاءة ولا يمكن استبدالها.» وهو يستدل على ذلك بخلايا البطانة الداخلية للأوعية الدموية: «إذا فقدت الخلايا البطانية في منطقة صغيرة من الوعاء الدموي قدرتها على التكاثر، ففنيت أو صارت عاجزة عن أداء وظيفتها، فإن هذا قد يؤدي لعمليات تنتهي بتصلب الشرايين.»وهو يضيف أن فقد القدرة على التكاثر يبدو أيضا أنه مشكلة في جهاز المناعة.
يتساءل سميث قائلا: «أنا غير متأكد أننا نموت بسبب شيء واحد محدد، ولكنني أعتقد أن فقد قدرة الخلايا على التكاثر قد يكون عاملا له سهم مشارك مهم.»ويوافق على ذلك G.V.كريستوفالو ، من الكلية الطبية في پنسلڤانيا وأحد كبار المدافعين عن الدراسات التي تجري خارج الجسم (في المختبر) in vitro. ففي محاضرة له في مؤتمر حديث عن البيولوجيا الجزيئية للشيخوخة، أشار إلى أن الخلايا التي تشيخ في المزارع تبدو مشابهة للخلايا التي تشيخ في الجسم. وهو يؤكد ذلك قائلا: إنه إضافة إلى فقد تلك الخلايا قدرتها التكاثرية تصبح أكبر حجما وتظهر تغيرات في بنيان نواها. ثم قال: «إنني سوف أكون في موقف صعب، لو أخذت أقيم الحجج على أن الخلايا لا تعمل شيئا عدا أنها تشيخ وفق أي تعريف نعتمده للشيخوخة.»
كيف يمكن للباحثين التوفيق بين النتائج الخاصة بخلايا الأرومات الليفية مع النظرية التطورية؟ يرى كثير من الباحثين، ومن بينهم سميث، أن الحد من القدرة التكاثرية قد يكون ناتجا ليس من برنامج خاص بالموت ولكن كوسيلة للدفاع ضد السرطان. وبناء على هذا قد تكون القدرة على التكاثر مثالا آخر للپيليوتروپية المتعارضة، و «البرنامج»الذي يساعدنا على مقاومة السرطان يحول في الوقت نفسه دون الخلود. وبالرغم من أن كثيرا من الناس يمرضون بالسرطان فإن المقاومة المستقرة في داخل أجسامنا تجعلنا أقل عرضة للأورام من الكثير من الحيوانات.
بحثا عن نظرية موحدة
على الرغم من التقدم الهائل الذي أحرزه الباحثون في دراساتهم عن الخلايا المزروعة وفي الأشقاق الطليقة وفي الجينات المحددة لطول العمر وفي غيرها من السبل الواعدة، فإن شيخوخة البشر مازالت كصندوق أسود. ومما يزيد الأمر اختلاطا وغموضا أن التغيرات المتعلقة بالعمر لا تحدث في الواقع بصورة مطّردة، سواء بين الأفراد (الذين يختلفون في قابليتهم للإصابة بعلل خاصة وفي تعرضهم للضغوط البيئية) أو بين الخلايا. وكما يقول فنش: «والمغزى الأكبر هو مدى الاصطفائية الملحوظ الذي تبلغه تغيرات عمرية معينة عند المستويات الجزيئية والخلوية والعضوية في أي نوع من الأنواع.»
ومع ذلك يعتقد فنش أن الموقف سوف ينجلي عن رؤية واضحة لعملية الشيخوخة. وهو يقول: «أما أنا فحدسي الداخلي أنه في غضون العشرين إلى الثلاثين سنة المقبلة سوف تبدع دراسة آليات الشيخوخة فهمًا متناميًا يربط بين المقاربات البيولوجية الطبية المنفصلة عن بعضها حتى حينه.»
ومن بين أكثر الأطراف أملاً بعض المستثمرين الذين يدعمون تطوير عقاقير وعلاجات جديدة قد تكون معادلة لينبوع الشباب، أو هي على الأقل في الوقت الحاضر ينابيع جزئية. فمثلا: تستثمر مؤسسات جديدة المركب PBN ومختلف أنواع إنزيم ديسميوتاز السوپرأكسيد في علاج مختلف الاضطرابات الشائعة عند تقدم السن.
ويقول وارنر: «إن الرأسماليين المغامرين يدعونه بثبات للحصول على آخر الاجتهادات عن الشيخوخة وربح الملايين من وراء ذلك.»
أما ما مدى إطالة العمر بالتعامل العشوائي مع الشيخوخة، فهذا متروك لتخمين أي إنسان. فقد سُجل أن جازونسكي، مثلا، يظن أن أقصى عمر يبلغه إنسان ـ وهو الآن نحو 120 سنة ـ قد يرتفع حتى يبلغ 400 سنة. ولكنه يظن أنه حتى الشخص الذي يتلقى علاجا، ولنقل، لثلاثين إلى خمسين سنة من الآن سيزداد عمره، على الأرجح، نحو ثلاثين سنة إضافية.
وبالطبع، فإن إطالة العمر، حتى ولو كانت إلى هذا الحد، يمكن أن يكون لها آثار اجتماعية واقتصادية وبيئية عميقة. ويثير هذا الاحتمال قضية يبدو أنها تلقى في الوقت الحاضر اهتماما منظما قليلا، ألا وهي: هل ينبغي أن تمتد بنا الحياة؟
وليس بمستغرب أن عددا من قادة الباحثين يعبرون عن تشككهم البالغ في استحسان ذلك. ويقول جونسون: إنه يخطط في تنظيم مناقشة جادة للموضوع، على الرغم من اقتناعه الفطري بأن الناس قد يعاملون الأرض باحترام أكبر لو عرفوا أنهم سيعيشون ليعانوا الآثار الناجمة عن وسائل تلويثهم إياها. ويردد فنش كلمات الآخرين قائلا: «إننا الآن نعمل هذا فعلا»، بالعناية بنظم غذائنا ومحاولتنا الحفاظ على نشاطنا.
ويقدم لنا روز إجابة مثيرة: «إذا قارنت إطالة العمر ببناء قنابل أخطر أو بوضع إنسان على القمر أو بأي من الأشياء الكثيرة التي يستطيع العلماء عملها باستخدام المال، فطبعا سيكون ذلك أعظم كثيرا، وإن لم يكن أفضل من تطعيم جميع أطفال بلدان العالم الثالث.»
المصادر
- ^ Hooyman, N.R.; Kiyak, H.A. (2011). Social gerontology: A multidisciplinary perspective (9th ed.). Boston: Pearson Education. ISBN 978-0205763139.
- ^ اتجاهات في البيولوجيا لماذا نشيخ؟
انظر أيضا
|
المصادر
17. Macieira-Coelho A., (2003) Biology of Aging, Progress in Molecular and Subcellular Biology, vol. 30, Springer-Verlag Berlin Heidelberg New York, ISSN 0079-6484, ISBN 3-540-43827-0.
قراءات إضافية
- VITALITY AND AGING: IMPLICATIONS OF THE RECTANGULAR CURVE. James F. Fries and Lawrence M. Crapo. W. H. Freeman and Company, 1981.
- MODERN BIOLOGICAL THEORIES OF AGING. H. R. Warner, R. N. Butler, R. L. Sprott and E. L. Schneider. Raven Press, 1987.
- LONGEVITY, SENESCENCE, AND THE GENOME. Caleb E. Finch. University of Chicago Press, 1990.
- MOLECULAR BIOLOGY OF AGING: PROCEEDINGS OF A UCLA COLLOQUIUM, HELD AT SANTA FE, N. M., MARCH 4-10, 1989. Edited by Caleb E. Finch and Thomas E. Johnson. Wiley-Liss, 1990.
- REVIEW OF BIOLOGICAL RESEARCH IN AGING, Vol. 4. Edited by Morton Rothstein. Wiley-Liss, 1990.
- EVOLUTIONARY BIOLOGY OF AGING. Michael R. Rose. Oxford University Press, 1991.
- Scientific American, December 1992
وصلات خارجية
- Aging Research Centre
- Biogerontologists (Gerontological Society of America)
- Biogerontology Resources
- Books on Gerontology published in 2007
- Careers in Aging
- Centre for Research on Ageing
- علم الشيخوخة at the Open Directory Project
- EPSRC funded research consortium dedicated to extending quality life
- Fall Prevention Center of Excellence
- Gerontology Research Group Site also has the official tables of known supercentenarians.
- Gerontology Fitness Research Group Geerontology Health and Fitness
- Gerontology Students Practice Resources
- Infogerontologia.com: recursos de gerontologia on-line (spanish)
- Journal of Gerontology Series A: Biological and Medical Sciences
- Journal of Gerontology Series B: Psychological and Social Sciences
- Mechanisms of Aging
- National Resource Center on Supportive Housing and Home Modification
- Ouroboros Biomedical Gerontology Research News
- People in Biogerontology
- Senescence.info: An introduction to Biogerontology
- University of Southern California Davis School of Gerontology
- Vitae Institute non-profit devoted to biogerontological education and under-funded basic research
- Wayne State University Institute of Gerontology
- U.S. Administration on Aging
- Leibniz Institute for Age Research - Fritz Lipmann Institute (FLI)
- [1] Biogerontology
- Health and Retirement Study (HRS) website
- Master´s Degree Programmes in Gerontology, University of Jyväskylä
- Fisher Institute for Wellness and Gerontology, Ball State University
- Finnish Centre for Interdisciplinary gerontology - FCIG