خلية بيضية
| Oocyte | |
|---|---|
 "Stripped" human oocyte; granulosa cells that had surrounded this oocyte have been removed. | |
| المصطلحات التشريحية |
خلية بيضية oocyte (UK: /ˈoʊəsaɪt/, US: /ˈoʊoʊ-/), oöcyte, ovocyte, أو نادراً ما تسمى ocyte[بحاجة لمصدر]، وهي خلية أنثوية عرسية أو خلية عروسية تشارك في التكاثر. بمعنى آخر، فهي بويضة غير ناضجة، أو خلية البويضة. يتم إنتاج البويضة في المبيض أثناء تولد الأمشاج الأنثوي. وتنتج الخلايا العروسية الأنثوية خلية عروسية بدائية (PGC)، والتي تخضع بعد ذلك للانقسام، مكونةً أوجونيا (خلية ثنائية الصبغيات صغيرة). وخلال تكون البويضة، تصبح الأوجونيا بويضات الأولية. البويضة هي شكل من أشكال المواد الجينية التي يمكن جمعها للحفظ بالتبريد.
التكوين

يسمى تكوين البويضة oocytogenesis ، وهو جزء من تكوين البويضات. [1]ينتج عن تكوّن البويضات تكوين البويضات الأولية خلال فترة الجنين ، و البويضات الثانوية بعد ذلك كجزء من الإباضة.
| Cell type | ploidy/chromosomes | chromatids | Process | Time of completion |
| Oogonium | diploid/46(2N) | 2C | Oocytogenesis (mitosis) | third trimester |
| primary Oocyte | diploid/46(2N) | 4C | Ootidogenesis (meiosis I) (Folliculogenesis) | Dictyate in prophase I for up to 50 years |
| secondary Oocyte | haploid/23(1N) | 2C | Ootidogenesis (meiosis II) | Halted in metaphase II until fertilization |
| Ootid | haploid/23(1N) | 1C | Ootidogenesis (meiosis II) | Minutes after fertilization |
| Ovum | haploid/23(1N) | 1C |
الخصائص
الهيولى
البويضات غنية بالهيولى ، والتي تحتوي على حبيبات صفار البيض لتغذية الخلية في وقت مبكر من التطور.
النواة
خلال مرحلة البويضات الأولية من تكوين البويضات ، تسمى النواة الحويصلة الجرثومية. [2]
النوع البشري الطبيعي الوحيد من البويضة الثانوية لديه الكروموسوم الثالث والعشرون (الجنس) مثل 23 ، X (محدد للإناث) ، في حين أن الحيوانات المنوية يمكن أن تحتوي على 23 ، X (محدد للإناث) أو 23 ، Y (محدد للذكور).
العش
المساحة الموجودة داخل البويضة أو البويضة غير الناضجة هي عش الخلية. [3]
مجمع الركام البويضي
يحتوي مجمع الركام البويضي على طبقات من الخلايا التراكمية المكدسة بإحكام والتي تحيط بالبويضة في جريب غراف. يتم إيقاف البويضة في الانقسام المنصف في مرحلة الطور الثاني وتعتبر بويضة ثانوية. قبل الإباضة ، يمر الركام المركب بتغيير هيكلي يُعرف باسم تمدد الركام. تتحول الخلايا الحبيبية من مضغوطة بإحكام إلى مصفوفة مخاطية موسعة. تظهر العديد من الدراسات أن تمدد الركام أمر بالغ الأهمية لنضج البويضة لأن مجمع الركام هو التواصل المباشر للبويضة مع بيئة الجريب النامية. كما أنه يلعب دورًا مهمًا في الإخصاب ، على الرغم من أن الآليات غير معروفة تمامًا وهي خاصة بالأنواع. [4][5][6]
مساهمات الأمومة
نظرًا لأن مصير البويضة هو أن تُخصب وتنمو في النهاية إلى كائن حي يعمل بكامل طاقته ، يجب أن تكون جاهزة لتنظيم العمليات الخلوية والنمائية المتعددة. يجب تزويد البويضة ، وهي خلية كبيرة ومعقدة ، بالعديد من الجزيئات التي ستوجه نمو الجنين وتتحكم في الأنشطة الخلوية. نظرًا لأن البويضة هي نتاج تكوين الأمشاج الأنثوي، فإن مساهمة الأمهات في البويضة وبالتالي البويضة المخصبة حديثًا ، تكون هائلة. هناك العديد من أنواع الجزيئات التي يتم إمدادها من الأم إلى البويضة ، والتي ستوجه الأنشطة المختلفة داخل اللاقحة.
تجنب إتلاف الخط الإنتاشي للحمض النووي
الحمض النووي للخلية معرض للتأثير الضار للجذور الحرة المؤكسدة التي تنتج كمنتجات ثانوية لعملية التمثيل الغذائي الخلوي. يمكن أن يكون تلف الحمض النووي الذي يحدث في البويضات ، إذا لم يتم إصلاحه ، مميتًا ويؤدي إلى انخفاض الخصوبة وفقدان النسل المحتمل. البويضات أكبر بكثير من متوسط الخلية الجسدية ، وبالتالي فإن النشاط الأيضي الكبير ضروري لتوفيرها. إذا تم تنفيذ هذا النشاط الأيضي بواسطة آلية التمثيل الغذائي الخاصة بالبويضة ، فسوف يتعرض مجموع مورثي البويضة إلى المنتجات الثانوية المؤكسدة التفاعلية المتولدة. وهكذا يبدو أن عملية تطورت لتجنب هذا الضعف في الحمض النووي للخط الإنتاشي. وقد اقتُرح أنه من أجل تجنب تلف مجموع مورثي الحمض النووي للبويضات ، تم تحويل عملية التمثيل الغذائي التي تساهم في خلق الكثير من مكونات البويضة إلى خلايا أمومية أخرى تقوم بعد ذلك بنقل هذه المكونات إلى البويضات. [7][8] وبالتالي ، فإن بويضات العديد من الكائنات الحية محمية من تلف الحمض النووي المؤكسد أثناء تخزين كتلة كبيرة من المواد لتغذية اللاقحة في نموها الجنيني الأولي.
مرسال الحمض النووي الريبي والبروتين
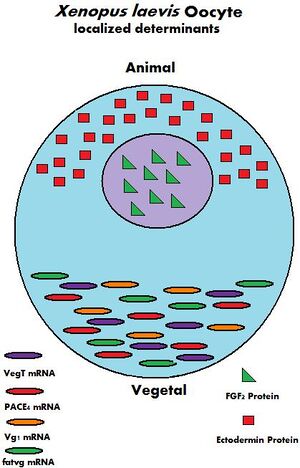
أثناء نمو البويضة ، يتم توفير مجموعة متنوعة من مرسال الحمض النووي الريبي ، أو mRNAs ، بواسطة خلايا الأم. يمكن تخزين mRNAs في مجمعات mRNP (مرسال الحمض النووي الريبي) وترجمتها في نقاط زمنية محددة ، ويمكن توطينها داخل منطقة معينة من الهيولى، أو يمكن تشتيتها بشكل متجانس داخل هيولى البويضة بأكملها. [9] يمكن أيضًا أن تكون البروتينات المحملة من الأم موضعية أو موجودة في كل مكان في جميع أنحاء الهيولى. المنتجات المترجمة من mRNAs والبروتينات المحملة لها وظائف متعددة ؛ من تنظيم "حفظ المنزل" الخلوي مثل تقدم دورة الخلية والتمثيل الغذائي الخلوي ، إلى تنظيم عمليات النمو مثل الإخصاب ، وتفعيل النسخ اللاقحي ، وتشكيل محاور الجسم. [9] فيما يلي بعض الأمثلة على mRNAs الموروثة من الأم والبروتينات الموجودة في بويضات ضفدع القيطم الأفريقي.
| Name | Type of maternal molecule | Localization | Function |
|---|---|---|---|
| VegT[10] | mRNA | Vegetal hemisphere | Transcription factor |
| Vg1[11] | mRNA | Vegetal hemisphere | Transcription factor |
| XXBP-1[12] | mRNA | Not known | Transcription factor |
| CREB[13] | Protein | Ubiquitous | Transcription factor |
| FoxH1[14] | mRNA | Ubiquitous | Transcription factor |
| p53[15] | Protein | Ubiquitous | Transcription Factor |
| Lef/Tcf[16] | mRNA | Ubiquitous | Transcription factor |
| FGF2[17] | Protein | Nucleus | Not known |
| FGF2, 4, 9 FGFR1[16] | mRNA | Not known | FGF signaling |
| Ectodermin[18] | Protein | Animal hemisphere | Ubiquitin ligase |
| PACE4[19] | mRNA | Vegetal hemisphere | Proprotein convertase |
| Coco[20] | Protein | Not known | BMP inhibitor |
| Twisted gastrulation[16] | Protein | Not known | BMP/Chordin binding protein |
| fatvg[21] | mRNA | Vegetal hemisphere | Germ cell formation and cortical rotation |
المتقدرة
تستقبل البويضة المتقدرات من خلايا الأم ، والتي ستستمر في التحكم في الأيض الجنيني وأحداث موت الخلايا المبرمج. [9] يتم تنفيذ تقسيم المتقدرة بواسطة نظام من الأنابيب الدقيقة التي ستوضع المتقدرة في جميع أنحاء البويضة. في بعض الكائنات الحية ، مثل الثدييات ، تتحلل المتقدرة الأبوية التي يتم إحضارها إلى البويضة بواسطة الحيوانات المنوية من خلال ارتباط البروتينات المنتشرة. يضمن تدمير المتقدرة الأبوية وراثة الأم للمتقدرة والحمض النووي للمتقدرة أو mtDNA. [9]
نوية
في الثدييات ، نوية البويضة مشتقة فقط من خلايا الأم. [22] النوية، وهي بنية موجودة داخل النواة ، هي المكان الذي يتم فيه نسخ مرسال الحمض النووي الريبي وتجميعه في ريبوسومات. في حين أن النوية كثيفة وغير نشطة في البويضة الناضجة ، فهي مطلوبة للتطور السليم للجنين.[22]
ريبوسوم
تصنع خلايا الأم أيضًا وتساهم في تخزين الريبوسوم المطلوبة لترجمة البروتينات قبل تنشيط مجموع مورثي اللاقحة. في بويضات الثدييات ، يتم تخزين الريبوسومات المشتقة من الأم وبعض مرسال الحمض النووي الريبي في بنية تسمى المشابك الهيولية. لوحظ أن هذه المشابك الهيولية، وهي شبكة من الألياف والبروتينات والحمض النووي الريبي ، تزداد في الكثافة مع انخفاض عدد الريبوسومات داخل البويضة النامية.[23]
الطور التمهيدي
تولد إناث الثدييات والطيور ولديها جميع البويضات اللازمة للإباضة في المستقبل ، ويتم إيقاف هذه البويضات في الطور التمهيدي من الانتصاف.[24] لدى البشر ، على سبيل المثال ، تتشكل البويضات بين ثلاثة وأربعة أشهر من فترة الحمل داخل الجنين ، وبالتالي فهي موجودة عند الولادة. خلال هذه المرحلة الأولية ، تتوقف مرحلة (راحة تكوين البويضات) ، والتي قد تستمر لسنوات عديدة ، وتوجد أربع نسخ من الجينوم في البويضات. يبدو أن التوقف في مرحلة نسخ الجينوم الأربعة يوفر التكرار المعلوماتي اللازم لـ ترميم الضرر في الحمض النووي من خط جنسي.[24] من المحتمل أن تتضمن عملية الترميم المستخدمة التأشيب المتماثل كل الإصلاح.[24][25] تتمتع البويضات الموقوفة من الطور الأولي بقدرة عالية على الترميم الفعال لأضرار الحمض النووي.[25] يبدو أن القدرة على ترميم الحمض النووي هي آلية لمراقبة الجودة الرئيسية في الخط التناسلي الأنثوي ومحدد حاسم لـ الخصوبة.[25]
المساهمات الأبوية
إن الحيوانات المنوية التي تخصّب البويضة ستساهم في النواة ، النصف الآخر من جينوم اللاقحة . في بعض الأنواع ، يساهم الحيوان المنوي أيضًا في مريكز ، والذي سيساعد في تكوين الجسيم المركزي للاقحة المطلوبة في القسم الأول. ومع ذلك ، في بعض الأنواع ، كما هو الحال في الفئران ، يتم اكتساب الجسيم المركزي بالكامل من الأم.[26] في الوقت الحالي، إن إمكانية وجود مساهمات سيتوبلازمية أخرى للجنين من قبل الحيوانات المنوية قيد التحقيق . أثناء الإخصاب ، يوفر الحيوانات المنوية ثلاثة أجزاء أساسية للبويضة: (1) عامل إشارة أو تنشيط ، مما يؤدي إلى تنشيط البويضة النائمة الأيضية ؛ (2) الجينوم الأبوي أحادي الصيغة الصبغية ؛ (3) الجسيم المركزي ، وهو المسؤول عن الحفاظ على نظام الأنابيب الدقيقة. انظر تشريح الحيوانات المنوية
الشذوذ
- عدم الانفصال - يمكن أن يؤدي فشل الفصل المتماثل الصحيح في الانقسام الاختزالي I، أو الفصل الشقيق كروماتيد في الانقسام الاختزالي الثاني إلى اختلال الصيغة الصبغية، حيث تحتوي البويضة على عدد خاطئ من الكروموسومات، على سبيل المثال 22 ، X أو 24 ، X. هذا هو سبب حالات مثل متلازمة داون ومتلازمة إدوارد لدى البشر. تزداد احتمالية حدوثه مع سن الأم المتقدم.
- تحتوي بعض البويضات على نوى متعددة، على الرغم من أنه يعتقد أنها لا تنضج أبدًا.
انظر أيضاً
- الحبيبات القشرية
- الحفظ بالتبريد للموارد الوراثية الحيوانية
- تكوين الجريبات
- مثبط نضج البويضات
- جسم قطبي
- كسر التناظر والدوران القشري
المراجع
- ^ answers.com
- ^ Biology-online
- ^ Grier HJ, Uribe MC, Parenti LR (April 2007). "Germinal epithelium, folliculogenesis, and postovulatory follicles in ovaries of rainbow trout, Oncorhynchus mykiss (Walbaum, 1792) (Teleostei, protacanthopterygii, salmoniformes)". Journal of Morphology. 268 (4): 293–310. doi:10.1002/jmor.10518. PMID 17309079. S2CID 23482731.
- ^ Yokoo M, Sato E (2004). "Cumulus-oocyte complex interactions during oocyte maturation". International Review of Cytology. 235: 251–91. doi:10.1016/S0074-7696(04)35006-0. ISBN 978-0-12-364639-2. PMID 15219785.
- ^ Tanghe S, Van Soom A, Nauwynck H, Coryn M, de Kruif A (March 2002). "Minireview: Functions of the cumulus oophorus during oocyte maturation, ovulation, and fertilization". Molecular Reproduction and Development. 61 (3): 414–24. doi:10.1002/mrd.10102. PMID 11835587. S2CID 5728551.
- ^ Huang Z, Wells D (October 2010). "The human oocyte and cumulus cells relationship: new insights from the cumulus cell transcriptome". Molecular Human Reproduction. 16 (10): 715–25. doi:10.1093/molehr/gaq031. PMID 20435609.
- ^ Bernstein C (1993). "Sex as a response to oxidative DNA damage. Chapter 10". In Halliwell B, Aruoma OI (eds.). DNA and Free Radicals. Great Britain: Ellis Horwood Limited. pp. 204–205. ISBN 978-0-13-222035-4.
- ^ Bernstein C (1998). "Sex as a response to oxidative DNA damage. Chapter 4". In Aruoma OI, Halliwell B (eds.). DNA and Free Radicals: Techniques, Mechanisms & Applications. Saint Lucia and London: OICA International. pp. 112–113. ISBN 976-8056169.
- ^ أ ب ت ث Mtango NR, Potireddy S, Latham KE (2008). "Oocyte quality and maternal control of development". International Review of Cell and Molecular Biology. 268: 223–90. doi:10.1016/S1937-6448(08)00807-1. PMID 18703408.
- ^ Zhang J, King ML (December 1996). "Xenopus VegT RNA is localized to the vegetal cortex during oogenesis and encodes a novel T-box transcription factor involved in mesodermal patterning". Development. 122 (12): 4119–29. doi:10.1242/dev.122.12.4119. PMID 9012531.
- ^ Heasman J, Wessely O, Langland R, Craig EJ, Kessler DS (December 2001). "Vegetal localization of maternal mRNAs is disrupted by VegT depletion". Developmental Biology. 240 (2): 377–86. doi:10.1006/dbio.2001.0495. PMID 11784070.
- ^ Zhao H, Cao Y, Grunz H (May 2003). "Xenopus X-box binding protein 1, a leucine zipper transcription factor, is involved in the BMP signaling pathway". Developmental Biology. 257 (2): 278–91. doi:10.1016/s0012-1606(03)00069-1. PMID 12729558.
- ^ Sundaram N, Tao Q, Wylie C, Heasman J (September 2003). "The role of maternal CREB in early embryogenesis of Xenopus laevis". Developmental Biology. 261 (2): 337–52. doi:10.1016/s0012-1606(03)00303-8. PMID 14499645.
- ^ Kofron M, Puck H, Standley H, Wylie C, Old R, Whitman M, Heasman J (October 2004). "New roles for FoxH1 in patterning the early embryo". Development. 131 (20): 5065–78. doi:10.1242/dev.01396. PMID 15459100.
- ^ Takebayashi-Suzuki K, Funami J, Tokumori D, Saito A, Watabe T, Miyazono K, et al. (September 2003). "Interplay between the tumor suppressor p53 and TGF beta signaling shapes embryonic body axes in Xenopus". Development. 130 (17): 3929–39. doi:10.1242/dev.00615. PMID 12874116.
- ^ أ ب ت Heasman J (February 2006). "Maternal determinants of embryonic cell fate". Seminars in Cell & Developmental Biology. 17 (1): 93–8. doi:10.1016/j.semcdb.2005.11.005. PMID 16426874.
- ^ Song J, Slack JM (December 1994). "Spatial and temporal expression of basic fibroblast growth factor (FGF-2) mRNA and protein in early Xenopus development". Mechanisms of Development. 48 (3): 141–51. doi:10.1016/0925-4773(94)90055-8. PMID 7893598. S2CID 20281053.
- ^ Dupont S, Zacchigna L, Cordenonsi M, Soligo S, Adorno M, Rugge M, Piccolo S (April 2005). "Germ-layer specification and control of cell growth by Ectodermin, a Smad4 ubiquitin ligase". Cell. 121 (1): 87–99. doi:10.1016/j.cell.2005.01.033. PMID 15820681. S2CID 16628152.
- ^ Birsoy B, Berg L, Williams PH, Smith JC, Wylie CC, Christian JL, Heasman J (February 2005). "XPACE4 is a localized pro-protein convertase required for mesoderm induction and the cleavage of specific TGFbeta proteins in Xenopus development". Development. 132 (3): 591–602. doi:10.1242/dev.01599. PMID 15634697.
- ^ Bell E, Muñoz-Sanjuán I, Altmann CR, Vonica A, Brivanlou AH (April 2003). "Cell fate specification and competence by Coco, a maternal BMP, TGFbeta and Wnt inhibitor". Development. 130 (7): 1381–9. doi:10.1242/dev.00344. PMID 12588853.
- ^ Chan AP, Kloc M, Larabell CA, LeGros M, Etkin LD (May 2007). "The maternally localized RNA fatvg is required for cortical rotation and germ cell formation". Mechanisms of Development. 124 (5): 350–63. doi:10.1016/j.mod.2007.02.001. PMC 2435194. PMID 17376659.
- ^ أ ب Ogushi S, Palmieri C, Fulka H, Saitou M, Miyano T, Fulka J (February 2008). "The maternal nucleolus is essential for early embryonic development in mammals". Science. 319 (5863): 613–6. doi:10.1126/science.1151276. PMID 18239124. S2CID 7799743.
- ^ Yurttas P, Vitale AM, Fitzhenry RJ, Cohen-Gould L, Wu W, Gossen JA, Coonrod SA (August 2008). "Role for PADI6 and the cytoplasmic lattices in ribosomal storage in oocytes and translational control in the early mouse embryo". Development. 135 (15): 2627–36. doi:10.1242/dev.016329. PMC 2708103. PMID 18599511.
- ^ أ ب ت Mira A (September 1998). "Why is meiosis arrested?". Journal of Theoretical Biology. 194 (2): 275–87. Bibcode:1998JThBi.194..275M. doi:10.1006/jtbi.1998.0761. PMID 9778439.
- ^ أ ب ت Stringer JM, Winship A, Zerafa N, Wakefield M, Hutt K (May 2020). "Oocytes can efficiently repair DNA double-strand breaks to restore genetic integrity and protect offspring health". Proceedings of the National Academy of Sciences of the United States of America. 117 (21): 11513–11522. doi:10.1073/pnas.2001124117. PMC 7260990. PMID 32381741.
- ^ Sutovsky P, Schatten G (2000). "Paternal contributions to the mammalian zygote: fertilization after sperm-egg fusion". International Review of Cytology. 195: 1–65. doi:10.1016/s0074-7696(08)62703-5. ISBN 978-0-12-364599-9. PMID 10603574.
المصادر
- Purves WK, Orians GH, Sadava D, Heller HC (2004). Life: The Science of Biology (7th ed.). Freeman, W. H. & Company. pp. 823–824. ISBN 978-0-7167-9856-9.
روابط خارجية
| سبقه None |
Stages of human development Sperm + Oocyte |
تبعه Zygote |