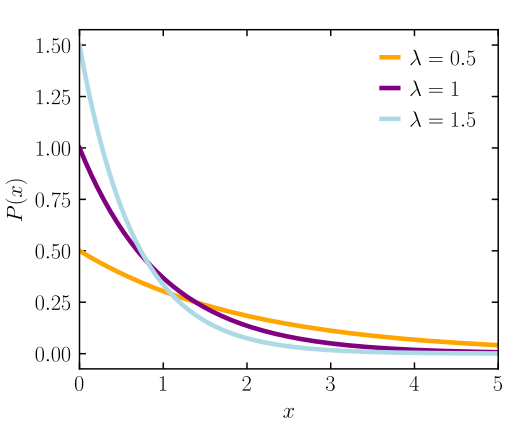
توزيع بولتسمان
في الكيمياء والفيزياء، معامل بولتسمان Boltzmann Factor، إذا تواجد عدد كبير من الجسيمات عند درجة حرارة T في توازن ترموديناميكي يكون احتمال ( تملك جسيم طاقة قدرها متناسبا مع معامل بولتزمان :
حيث ثابت بولتسمان.
عنما يسود توازن ترموديناميكي في نظام معزول من غاز مكون من عدد كبير من الجسيمات تتصادم الجسيمات بعضها البعض، فتفقد الجسيانت ذات السرعة العالية جزءاً من طاقتها الحركية فتقل سرعتها، وتكتسبها جسيمات أخرى بطيئة فترفع من سرعتها وبالتالي ترفع من طاقتها الحركية. وبعد فترة من الزمن نصل إلى حالة توازن الحركة الحرارية في النظام. وقد قام العالم الألماني بولتسمان بدراسة هذا التوازن، وبين أن سرعات الجسيمات في النظام تتخذ توزيعا معينا اسمه توزيع بولتسمان، تقل فيه الرعات العالية وتقل فيه السرعات البطيئة، ويكون معظم التوزيع في حيز معين من السرعات المتوسطة وتعتمد على درجة الحرارة. يعطينا توزيع بولتزمان احتمال تملك جسيم سرعة معينة في النظام، وبالتالي تملكه طاقة معينة.
فإذا قمنا بتقسيم طاقة الجسيمات إلى شرائح فقد يوجد داخل الشرائح شرائح أصغر منها، فيكون احتمال تملك جسيم لطاقة معينة معتمدا على كثافة طاقة الحالة وعلى معامل بولتسمان.
يلعب معامل بولتزمان دوراً هاماً في الميكانيكا الإحصائية وفي الديناميكا الحرارية (أنظر احصاء بولتسمان)، ويجري تقديره على أساس احصائي لعدد كبير جدا من الجسيمات، بدون التعرض إلى التآثر (قوي الجذب مثلا) بين الجسيمات في نظام حركي حراري.
أمثلة على استخدامه
- انخفاض الضغط بالارتفاع
{{رئيسي|[[تغير الضغط بالارتفاع}}
ينخفض الضغط الجوي بالرتفاع عن سطح البحر. فإذا كانت كتلة جزيئ الهواء لكانت طاقة وضعه على الارتفاع تبلغ ، حيث g عجلة الجاذبية الأرضية.
ويكون احتمال وجود جزيئ الهواء على هذا الارتفاع متناسبا مع:
لكي يبدأ تفاعل كيميائي فلا بد من حصول النظام الداخل في التفاعل على طاقة التنشيط المولية . ويتناسب ثابت سرعة التفاعل تناسبا طرديا مع:
- منحنى ضغط البخار
يحتاج سائل للتحول إلى حالة غازية إلى امتصاص حرارة التبخر المولية (أو بمعنى أدق الإنتثلبي). ويتناسب ضغط البخار (عند التشبع) تناسبا طرديا مع:
اقرأ أيضاً
- معادلة أرينيوس
- تفاعل كيميائي
- مخطط أرنيوس
- تغير الضغط بالارتفاع
- تفاعل ناشر للحرارة
- تفاعل يمتص الحرارة
- تفاعل الثرميت
- تفاعل أكسدة-اختزال
- اختزال
- نظرية تحول الحالة
- تفاعل نووي