اصطياد إلكترون
اصطياد إلكترون في الفيزياء (بالإنجليزية: Electron Capture) هو أحد أنواع النشاط الإشعاعي للعناصر الغير مستقرة ، وعن طريق اصطياد إلكترون تصل نواة الذرة إلى حالة نواة مستقرة ، وذلك عن طريق اصتيدها لأحد لكتروناتها الموجودة في مدار قريب منها وابتلاعه .
تنبأ الفيزيائي الياباني يوكاوا هيديكي عن إمكانية النواة الذرية لامتصاص أحد إلكتروناتها نظريا عام 1935 ثم اكتشفة لويس ألفاريز عمليا عام 1937 عند دراسته للجاليوم-67.
وتتم عملية اصطياد النواة الذرية لأحد إلكتروناتها عن طريق التآثر الضعيف وتنتمي العملية إلى تحلل بيتا. وتتحول النواة إلى نواة إبنة بها نفس عدد النيوكليونات كما يحدث في تحلل بيتا (+) .
وصفه
مثلما في تحلل بيتا(+) يحافظ اصطياد الإلكترون على الشحنة عن طريق تحول أحد البروتونات إلى نيوترون وإصدار نيوترينو ، حيث لا يتغير مجموع البروتونات والنيوترونات في النواة الذرية . وخلال تلك العملية تكتسب النواة طاقة السكون للإلكترون الذي اغتنمته، طبقا للتفاعل :
حيث :
- p البروتون
- e الإلكترون
- n النيوترون
- نيوترينو.
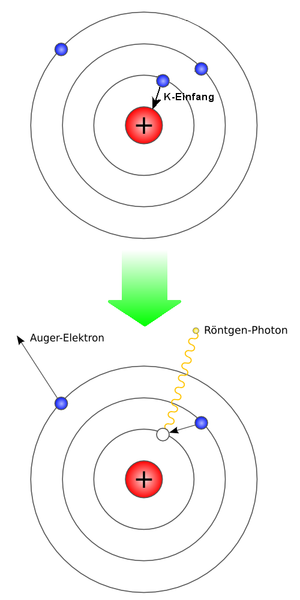
وتتميز إلكترونات الغلاف الذري K بأكبر احتمال لتواجدها قريبة من النواة ، ولذلك يكون اصطياد النواة لأحد إلكترونات الغلاف الذري تكون بنسبة 90 % من الغلاف (التحتي) K . ولذلك يسمى هذا النوع للاصتياد "اصطياد-K-Capture "K . أما اصطياد إلكترونا من الغلاف-L أو الغلاف-M (وهما أعلى من الغلاف-K ) ، فيكون احتمالهما أقل.
وعند تحول النواة بهذه الطريقة فهي تطلق الطاقة الزائدة فيها وذلك عن طريق إعطائها للنيوترينو في هيئة طاقة حركة وقد يكون ذلك جزئيا. ولهذا تكون الطاقة القصوى التي ينطلق بها النيوترينو من النواة مساوية لطاقة الربط Binding energy للإلكترون الذي اصتادته النواة .
وقد تعطي النواة الجديدة {daughter nucleus} للنيوترينو جزءا من الطاقة الزائدة وتحتفظ بجزء منها وتبقى النواة في حالة إثارة. ويتميز هذا التصرف أن النيوترينوات المنطلقة من عدة أنوية يكون لكل منها طاقة غير الآخر ، وذلك بحسب جزء الطاقة التي احتفظت النواة . وعندما تتخلص النواة المثارة من طاقة الإثارة فهي تصدرها في هيئة شعاع جاما وتصبح هي في الحالة الأرضية المستقرة.
عندما يُلتقط الإلكترون من مداره في الغلاف-K من النواة فإنه يترك ورائة مكانا خاليا في الغلاف-K ولا تستطيع الذرة البقاء على هذا الحال ، فيقفز أحد الإلكترونات من المدارات العليا لشغر المكان الخالي من الإلكترون الذي اصتادته النواة ، ويكون ذلك مصحوبا بإصدار الإلكترون الساقط من مدار علوي لشعاع جاما .
احتمالية اصطياد الإلكترون
بينما يعتمد تحلل بيتا على حالة نواة الذرة نفسها ، فإن اصطياد النواة للإلكترون تعتمد على حالة النواة وأيضا حالة الغلاف الإلكتروني ، وبصفة خاصة على احتمال تواجد إلكترون قريبا جدا من النواة . ولذلك يتغير احتمال تحلل النواة الذرية بطريق اصطياد الإلكترون بحسب نوع الرباط الكيميائي للذرة . وقد تبين من التجارب تغييرات في عمر النصف في حدود 1 % للتحلل عن طريق اصطياد إلكترون . [1]
امثلة
التحلل بطريق اصطياد إلكترون إلى جانب تحلل بيتا :
ويوجد نظير البوتاسيوم-40 ، وهو يتميز بأنه يتحلل بثلاثة طرق : تحلل بيتا و تحلل بيتا إلى جانب اصطياد إلكترون:
1) اصطياد إلكترون ، يتحول البوتاسيوم إلى أرجون Ar ، نسبة التحلل 11 %:
2) تحلل بيتا ،يتحول البوتاسيوم إلى الكالسيوم Ca ، نسبة التحلل 89 %:
3) تحلل بيتا ، نسبة التحلل 001و0 %:
ويؤثر الرباط الكيميائي على معدل اصطياد النواة لإلكترون تأثيرا طفيف في حدود أقل من 1% ،وهذا يعتمد على الذرات المجاورة. وعلى سبيل المثال يبلغ هذا التغير نحو 9و0 % في تحلل البيريليوم-7 وقد شوهد ذلك في عمر النصف لمعدن البيريليوم و في حالة ارتباطة في مادة عازلة.
[2]
وهذا يعتبر تأثير كبير نسبيا ، ويعزى ذلك إلى أن ذرة البيريليوم من الذرات الصغيرة التي تكون إلكترونات تكافؤها قريبة من النواة .
وعبر العناصر الموجودة في منتصف الجدول الدوري و بالتالي في منتصف جدول النظائر تكون النظائر الأخف من نظائرها المستقرة تميل إلى التحلل عن طريق اصطياد إلكترون ، بينما يميل النظير الذي هو أثقل من نظيره المستقر للتحلل عن طريق تحلل بيتا .
أمثلة شائعة
بعض النظائر المشعة الشائعة التي تنحل باصطياد الإلكترون تضم:
| نظير مشع | وقت النصف |
|---|---|
| unknown element Link. | 53.28 d |
| unknown element Link. | 35.0 d |
| unknown element Link. | 1.03E5 a |
| unknown element Link. | 52 a |
| unknown element Link. | 337 d |
| unknown element Link. | 27.7 d |
| unknown element Link. | 3.7E6 a |
| unknown element Link. | 271.8 d |
| unknown element Link. | 6.10 d |
| unknown element Link. | 3.260 d |
| unknown element Link. | 270.8 d |
| unknown element Link. | 8.5 d |
للقائمة الكاملة، انظر جدول النيوكليدات.
المراجع
- ^ G. T. Emery, Perturbation of Nuclear Decay Rates, Annu. Rev. Nucl. Sci. 22 (1972) S. 165-202
- ^ B.Wang et al., Euro. Phys. J. A 28, 375-377 (2006) Change of the 7Be electron capture half-life in metallic environments
انظر أيضا
وصلات خارجية
 The LIVEChart of Nuclides - IAEA with filter on electron capture, in Java or HTML
The LIVEChart of Nuclides - IAEA with filter on electron capture, in Java or HTML