أكسيد الكادميوم

| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Cadmium oxide
| |
| أسماء أخرى
Cadmium(II) oxide,
Cadmium monoxide | |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.013.770 |
| رقم EC |
|
| رقم RTECS |
|
| UN number | 2570 |
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | CdO |
| كتلة مولية | 128.41 g mol-1 |
| المظهر | colorless powder (alpha form) red-brown crystal (beta form) [1] |
| الكثافة | 8.150 g/cm3(crystalline), 6.95 g/cm3 (amorphous)[2] solid. |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | insoluble |
| قابلية الذوبان في acid and alkaline | degrades |
| حركية الإلكترون | 531 cm2/V s |
| القابلية المغناطيسية | -3×10−5 cm3/mol |
| التوصيل الحراري | 0.7 W/m-K |
| البنية | |
| البنية البلورية | cubic, cF8 |
| الزمرة الفراغية | Fm3m, No. 225 |
| ثابت العقد | a = 4.6958 Å |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
Carc. Cat. 2 Muta. Cat. 3 Repr. Cat. 3 Very toxic (T+) Dangerous for the environment (N) |
| توصيف المخاطر | R45, R26, قالب:R48/23/25, R62, R63, R68, R50/53 |
| تحذيرات وقائية | S53, S45, S60, S61 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Non-flammable |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كبريتيد الكادميوم سيلينيد الكادميوم تيلوريد الكادميوم |
كاتيونات أخرى
|
أكسيد الزنك أكسيد الزئبق |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
أكسيد الكادميوم مركب كيميائي له الصيغة CdO ، ويكون على شكل بلورات حمراء بنية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص
- انحلالية أكسيد الكادميوم في الماء ضعيفة جداً، كذلك لا ينحل في القلويات، إلا ينحل في كل من الأحماض ومحاليل أملاح الأمونيوم.
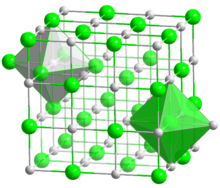
- البنية البلورية لأكسيد الكادميوم مشابهة لكلوريد الصوديوم بنية مكعبية مركزية الوجوه.
- الناقلية الكهربائية لبلورات أكسيد الكادميوم جيدة.
التحضير
يحضر أكسيد الكادميوم من تفاعل مصهور فلز الكادميوم مع أكسجين الهواء:
- Cd + 1/2 O2 →CdO
الاستخدامات
يستخدم كحفاز في الاصطناعات العضوية.
المصادر
- Taschenbuch chemische Substanzen, Willmes, Verlag Harri Deutsch, ISBN 3-8171-1662-4
- [1]
وصلات خارجية
- ^ Patnaik, Pradyot (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. ISBN 0070494398.
- ^ "NIOSH Pocket Guide to Chemical Hazards". Retrieved 2007-02-16.
