معايرة حمض-قاعدة
(تم التحويل من Acid–base titration)
معايرة حمض-قاعدة Acid–base titration، هو تحديد تركيز حمض أو قاعدة عن طريق التحديد الدقيق للحمض أو القاعدة بواسطة حمض أو قاعدة ذات تركيز معروف. يسمح هذا بالتحليل الكمي لتركزي المحلول أو القاعدي المعروف. تستخدم معايرات الحمض-الأساس أيضاً لمعرفة نسبة نقاء الكيماويات.
القلوية والحمضية
التجهيزات
التجهيزات الرئيسية المستخدمة في المعايرة هي:
- السحاحة
- البلاط الأبيض - يستخدم لرؤية تغير اللون في المحلول
- الممص
- مؤشر الأس الهيدروجيني
- دورق إرلنماير/ دورق مخروطي
- المعاير (محلول قياسي ذو تركيز معروف، الأكثر شيوعاً هو كربونات الصوديوم المائية)
- الحليلة (سائل ذو تركيز غير معروف)
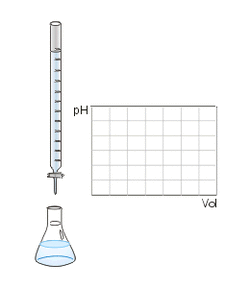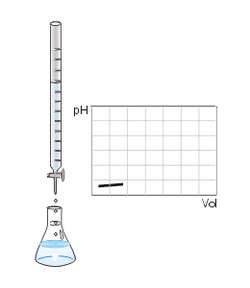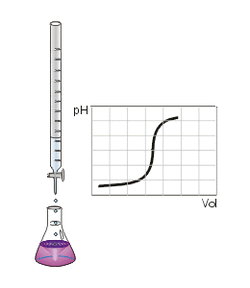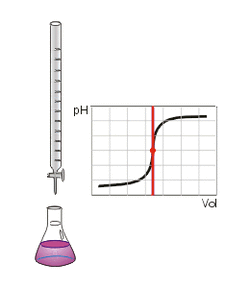
الطريقة
معايرة الحمض الضعيف