ليتموس
ليتموس Litmus هو خليط قابل للذوبان في الماء من صباغ مستخلص من الأشنة. غالباً ما يتم امتصاصه في ورق الترشيح لإنتاج أحد أقدم أشكال مؤشر الأس الهيدروجيني، المستخدم لاختبار المواد من أجل الحموضة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
تم استخدام ليتموس لأول مرة في حوالي عام 1300 من قبل الطبيب الإسپاني أرنولدس دو ڤيلا نوڤا.[1] منذ القرن السادس عشر فصاعداً، تم استخراج الصبغة الزرقاء من بعض الأشنات، خاصة في هولندا. تأتي كلمة ليتموس من الكلمة الإسكندناڤية القديمة التي تعني "صبغ" أو "لون". بينما تعمل جميع أوراق ليتموس كورق الأس الهيدروجيني، فإن العكس ليس صحيحاً.
المصادر الطبيعية
يمكن العثور على ليتموس في أنواع مختلفة من الأشنيات. يتم استخراج الأصباغ من أنواع مثل روكسيلا تنكتوريا (أمريكا الجنوبية)، روكسيلا فوسيفورمس (أنغولا ومدغشقر)، روكسيلا پگمايا (الجزائر)، روكسيلا فيكوپسس، لكانورا تارتيريا (النرويج، السويد)، ڤاريوليريا ديلباتا، أوكرلوكيا پاريلا، پارموتريما تنكتوروم و پارميليا. حالياً، المصادر الرئيسية هي روكسيلا مونتانيي (موزمبيق) وليوكوفيا شجيرية (كاليفورنيا).[1]
الاستخدامات
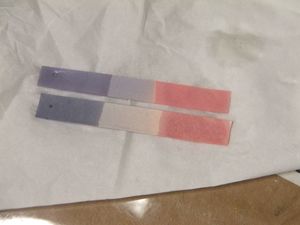
الاستخدام الرئيسي لليتموس هو اختبار ما إذا كان المحلول حمضياً أو أساسياً. يتحول ورق ليتموس الأزرق الفاتح إلى اللون الأحمر في الأوساط الحمضية ويتحول ورق ليتموس الأحمر إلى اللون الأزرق في الأوساط الأساسية أو الأوساط القلوية، مع تغير اللون الذي يحدث على نطاق الأس الهيدروجيني 4.5-8.3 عند 25 درجة. يكون ورق ليتموس المحايد أرجواني.[1] يمكن أيضاً تحضير ليتموس في صورة محلول مائي يعمل بشكل مشابه. في الأوساط الحمضية، يكون المحلول أحمر، وفي الأوساط القلوية، يكون المحلول أزرق.
يمكن أيضاً استخدام ورق ليتموس الرطب لاختبار الغازات القابلة للذوبان في الماء والتي تؤثر على الحموضة أو القاعدية؛ يذوب الغاز في الماء ويؤدي المحلول الناتج إلى تلوين ورق ليتموس. على سبيل المثال، يتحول غاز الأمونيا، وهو قلوي، إلى ورق ليتموس الأحمر إلى اللون الأزرق.
| Litmus (مؤشر الأس الهيدروجيني) | ||
| تحت الأس الهيدروجيني 4.5 | فوق الأس الهيدروجيني 8.3 | |
| 4.5 | ↔ | 8.3 |
يمكن أن تتسبب التفاعلات الكيميائية بخلاف القاعدة الحمضية في تغير لون ورق ليتموس. على سبيل المثال، يتحول الغاز الكلور إلى ورق ليتموس الأزرق إلى الأبيض – يتم تبييض صبغة ليتموس،[2]بسبب وجود أيونات هيپوكلوريت. رد الفعل هذا غير معكوس، لذا ليتموس لا يعمل كمؤشر في هذه الحالة.
الكيمياء
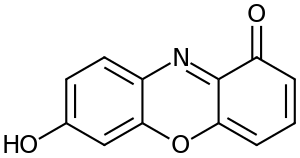
يحتوي خليط ليتموس على رقم تسجيل المركب الكيميائي 1393-92-6 ويحتوي على 10 إلى 15 صبغة مختلفة. من المحتمل أن تكون جميع المكونات الكيميائية في ليتموس مماثلة لتلك الموجودة في الخليط ذي الصلة المعروف باسم أورسين، ولكن بنسب مختلفة. على النقيض من أورسين، فإن المكون الرئيسي ليتموس له متوسط كتلة جزيئية من 3300.[3] تدين مؤشرات القاعدة الحمضية في ليتموس بخصائصها إلى حامل اللون 7-هيدروكسي فينوكسازون.[4]أعطيت بعض الكسور من ليتموس أسماء محددة بما في ذلك إريثرولتمن (أو إريثرولين)، أزوليتمين، سانيوليتمين، ليكورسين، وليوكازوليتمين. يُظهر أزولتمين نفس تأثير ليتموس تقريباً.[5]
الآلية
الليتموس الأحمر يحتوي على حمض ثنائي البروتين ضعيف. عندما تتعرض لمركب قاعدي، تتفاعل أيونات الهيدروجين مع القاعدة المضافة. القاعدة المترافقة المكونة من حمض ليتموس لها لون أزرق، لذا يتحول ورق ليتموس الأحمر الرطب إلى اللون الأزرق في محلول قلوي.
المراجع
- ^ أ ب ت Manfred Neupert: Lackmus in Römpp Lexikon Chemie (German), January 31, 2013.
- ^ O'Leary, Donal (2000). "Chlorine". The Chemical Elements. Archived from the original on 2008-12-21.
- ^ Beecken, H.; E-M. Gottschalk; U. v Gizycki; H. Krämer; D. Maassen; H-G. Matthies; H. Musso; C. Rathjen; Ul. Zdhorszky (2003). "Orcein and Litmus". Biotechnic & Histochemistry. 78 (6): 289–302. doi:10.1080/10520290410001671362. PMID 15473576. S2CID 41944320.
- ^ H. Musso, C. Rathjen (1959). "Orcein dyes. X. Light absorption and chromophore of litmus". Chem. Ber. 92 (3): 751–3. doi:10.1002/cber.19590920331.
- ^ E.T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht 1846, Verlag E. Anton (Germany)