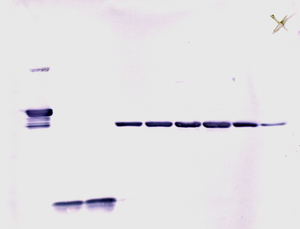
لطخة غربية
في التقنيات الحيوية، اللطخة الغربية إنگليزية: Western Blot (تعرف أيضا باللطخة المناعية Immunoblot) هي طريقة اكتشاف بروتين معين في عينة أو مستخلص أنسجة، وهي من التقنيات الحيوية المخبرية. تستخدم الفصل الكهربائي للهلام لفصل البروتينات الطبيعية native proteins أو البروتينات المُتَمَسِّخة denatured proteins حسب طول السلاسل البروتينية (ظروف مفككة) أو حسب الشكل الثلاثي الأبعاد للبروتين (ظروف قومية/غير مفككة). يتم، في ما بعد، نقل البروتينات إلى غشاء (عادة ما يكون الغشاء مصنوعا من مادة النيتروسليولوز أو PVDF)، حيث يتم التحقق (الاكتشاف) باستخدام أضداد مخصصة للبروتين الهدف. هناك الآن العديد من شركات المواد التي تتخصص في تجهيز أضداد (مستنسخة ومتعددة النسائل) ضد آلاف البروتينات المختلفة. وقد أذى ذلك إلى تقليل الوقت الذي تحتاجه لعمل لطخة بصورة كبيرة.
كان يجب، سابقًا، تلقيح الحيوانات الكبيرة (مثل: الخرفان، العنز - يحتويان على الكثير من المصل) بالبروتين المستهدف مرتين (حيث أن الاستجابة المناعية الثانية تنتج أضدادا أكثر). ومن ثم إما يتم تصفية المصل واستخدامه (أضداد متعددة النسائل - Polyclonal -) أو يمكن فصل الخلايا البائية من الحيوان ودمجها خارج الجسم in vitro مع خلايا فأر سرطانية لتوليد خلايا هيبريدوما التي تستطيع في ما بعد إنتاج أضداد وحيدة النسيلة (Monoclonal).
الأضداد التجارية عادة ما تكون مكلفة، ولكن يمكن إعادة استخدامها (استخدام ما يتبقى من الأجسام المضادة غير الملتصقة) بين التجارب. هذه الطريقة تستخدم في الأحياء الجزيئية، الكيمياء الحيوية، وعلم الجينات المناعية Immunogenetics وعدة أخرى من علوم الأحياء الجزيئية.
من التقنيات الأخرى المتعلقة هي استخدام الأجسام المضادة لاكتشاف البروتينات في الأنسجة أو الخلايا باستخدام الصبغة المناعية Immunostaining والإلايزا ELISA.
تم صنع هذه الطريقة في مختبر جورج ستارك في جامعة ستانفورد عام 1981. قام وولتر نيل بورنيت بتسميتها باسم "اللطخة الغربية"،[1] [2] وهو مشتق من اسم اللطخة الجنوبية (Southern Blot بالإنكليزية، من Southern وهي نسبة إلى إدون ساذرن Edwin Southern، والتي تعني أيضا الجنوبي بالإنكليزية. فسميت التقنية الجديدة بـالغربية، تلاعبا بالمعنى). واللطخة الجنوبية تقنية لاكتشاف الحمض الريبي النووي منقوص الأكسجين DNA، قام إدون ساذرن Edwin Southern بصنعها عام 1975. تسمى طريقة اكتشاف الحمض الريبي النووي RNA باسم اللطخة الشمالية.
خطوات اللطخة الغربية
تحضير الأنسجة
يمكن أخذ العينات من أنسجة كاملة أو من زراعة الخلايا. يتم كسر الأنسجة الصلبة ميكانيكيًا، في أغلب الأحيان، باستخدام خلاّط (لأحجام عينات كبيرة)، باستخدام مجنس homogenizer (للأحجام الأصغر)، أو بالصوتنة Sonication. يمكن كسر وفتح الخلايا بإحدى الطرق المذكورة أعلاه أيضًا.
يمكن توظيف العديد من المنظفات والأملاح والمحاليل لتشجيع التكسر الخلوي ولإذابة البروتينات. يتم أيضًا إضافة مثبطات (موانع) البروتييزات والفسفاتيزات Protease and Phosphatase Inhibitors وذلك لمنع تآكل العينة بإنزيماتها الخاصة.
يتم استخدام مجموعة من التقنيات الميكانيكية والكيمياحيوية (البايوكيميائية) من ضمنها أيضًا العديد من أنواع التصفية والطرد المركزي لفصل أجزاء أو عضيات معينة من الخلايا.
الفصل الكهربائي للهلام
 مقالة مفصلة: فصل كهربائي للهلام
مقالة مفصلة: فصل كهربائي للهلام
يتم فصل بروتينات العينة باستخدام الفصل الكهربائي. فصل البروتينات قد يكون باستخدام النقطة متوازنة الكهربة Isoelectric point (pI)، الوزن الجزيئي، الشحنة الكهربائية، أو مجموعة من هذه العوامل. طبيعة الفصل تعتمد على طريقة معالجة العينة وطبيعة الهلام.
إلى حد الآن، الطريقة الأكثر شيوعاً للفصل الكهربائي للهلام توظف هلامات متعدد الأكريلامايد polyacrylamide ومحاليل تحتوي على كبريتات دوديكل الصوديوم Sodium Dodecyl Sulfate (SDS).
SDS-PAGE أي (الفصل الكهربائي لهلام كبريتات دوديكل الصوديوم متعددالأكريلامايد SDS-Polyacrylamide Gel Electrophoresis) تحافظ على سلسلة البروتيات في حالة مفككة denatured state حالماً يتم معالجتهم مع عوامل اختزال قوية للقضاء على الأشكال الثانوية والثالثية. (مثل تحويل الروابط ثنائية الكبريت S-S إلى SH و SH) وبذلك يسمح لفصل البروتينات حسب وزنهم الجزيئي. يتم تغطية البروتينات في العينة بكبريتات دوديكل الصوديوم السالبة الشحنة ونقلها إلى القطب الكهربائي الموجب الشحنة خلال شبكة الأكريلامايد في الهلام. البروتينات الصغيرة تهاجر أسرع خلال هذه الشبكة وبذلك يتم فصل البروتينات حسب الحجم (عادة ما يتم قياسها بالكيلودالتون، kD، kiloDaltons). تركيز الأكريلامايد يحدد دقة الهلام - كلما زاد تركيز الأكريلامايد كلما زادت دقة البروتينات ذات الأوزان الجزيئية العالية. البروتينات تهاجر ببعد واحد خلال الهلام لأغلب اللطخات.
يتم تحميل العينات في آبار في الهلام. يتم حفظ إحدي الأسطر للـ درج أو العلامات، وهما خليط متوفر تجارياً من عدة بروتينات معروفة الوزن الجزيئي، عادة ما تكون مصبوغة لكي تُظهر حزم ملونة مرئية. أحد الأمثلة على الدرج، هو درج الأوزان الجزيئية الكامل المدى لشركة GE (كما في الشكل). عندما يتم تطبيق فرق الجهد على الهلام، تهاجر البروتينات ضمنه بسرع مختلفة. هذه المعدلات الزمنية المختلفة للتقدم (حركات الفصل الكهربائي المختلفة) تُفصل إلى حُزم ضم كل سطر.
من الممكن أيضاً استخدام الفصل الكهربائي ثنائي الأبعاد الذي يفصل البروتينات من عينة واحدة في بُعدين. البروتينات تفصل بحسب النقطة متوازنة الكهربة (تركيز أيونات الهيدروجين pH الذي تكون فيه الشحنة متعادلة) في البعد الأول، وبحسب الوزن الجزيئي في البعد الثاني.
النقل
من أجل جعل الوصول للبروتينات أسهل للأكتشاف بالأجسام المضادة، يتم نقلهم من الهلام إلى غشاء مصنوع من النيتروسيليوز أو الـPVDF. يتم وضع هذا الغشاء فوق الهلام، ووضع مجموعة من طبقات أوراق الترشيح فوق ذلك. ثم يتم وضع الطبقات كلها في محلول يقوم بالتنقل إلى الأعلى عبر الأوراق بالخاصية الشعرية Capillary action، جالباً البروتينات معه إلى الغشاء.
ومن الطرق الأخرى لنقل البروتينات تدعى اللطخة الكهربائية وتستخدم تياراً كهربائي لسحب البروتينات من الهلام إلى الغشاء.
البروتينات الآن نُقلت من داخل الهلام إلى سطح غشاء من النيتروسيليلوز أو PVDF مع ثباء الترتيب التي كانت البروتينات عليه داخل الهلام. ويكون ناتج هذه العملية، هو عرض البروتينات على سطح رقيق للاكتشاف (انظر أسفلاً). كلا نوعي الغشاء (نيتروسيليلوز أو PVDF) يتم اختيارهم لخاصية الالتصاق غير المحدد بالبروتيات (أي أنهم يلتصقون بأي بروتين بصورة متساوية). التصاق البروتينات مبني على تفاعلات مصابة بفوبيا الماء hydrophobic interactions)، بالإضافة إلى التفاعلات المشحونة بين الغشاء والبروتين. إن أغشية النيتروسيليلوز تكون أقل كلفة من الـ PVDF، ولكنهم هشة أكثر ولا تستطيع الوقوف لتحقيقات مجددة reprobes كثيرة.[3]
التأثير الكلّي والموحّد لنقل البروتين من الهلام إلى الغشاء يمكن التأكد منه بصبغ الغشاء بصبغة كوماسي Coomassie أو بونسو س Ponceau S. كوماسي هي الصبغة الأكثر حساسية من الصبغتين، بالرغم من أن سهولة ذوبان بونسو س في الماء تجعله أسهل للإزالة لاحقاً والتحقق من الغشاء كما في أدناه.[4]
السد
بما أنه تم اختيار الغشاء لقابليته على الالتصاق بالبروتينات، وكلاً من الأجسام المضادة والأهداف هما بروتينات، يجب إتخاذ إجراءات خاصة لمنع التفاعلات بين الغشاء والجسم المضاد المستخدم لاكتشاف البروتين الهدف. يتم سد الالتصاق غير المحدد عن طريق وضع الغشاء في محلول مخفف من بروتين - عادة ما يكون هذا البروتين هو ألبومين مصل البقر Bovine Serum Albumin المعروف بالـ BSA أو حليب من غير دهون (كلاهما ليسا مكلفان)، مع مقدار صغير من منظف مثل توين 20 Tween. البروتين في المحلول المخفف يلتصق بالغشاء في كل الأماكن الغير محتوية على البروتينات الهدف. وبهذا، عندما يتم إضافة الجسم المضاد، لن يكون هناك مكان له ليلتصق غير على مواقع الالتصاق على البروتين الهدف المحدد. هذا يقلل "التشويش" في النتيجة النهائية لللطخة الغربية، ويؤدي إلى نتائج أوضح، ويقضي على النتائج الإيجابية المزيفة.
الاكتشاف
خلال عملية الاكتشاف، يتم التحقق من وجود البروتين المطلوب على الغشاء عن طريق جسم مضاد معدل مرتبط بإنزيم مراسل، الذي عند وضع مادة معينة عليه يسبب تفاعل لوني ويقوم بإنتاج لون معين. ولعدة أسباب، فإن هذه الخطوة تتم بخطوتين، بالرغم من أن الآن يوجد طرق اكتشاف ذات خطوة واحدة لبعض الاستخدامات.
الخطوتين
- الجسم المضاد الأولي
يتم تكوين الأجسام المضادة عندما يتم عرض البروتين المطلوب (أو جزءاً منه) على المستضيف أو خلايا المناعة المزروعة. عادةً، يكون هذا جزءاً من الإستجابة المناعية، ولكن هنا يتم حصد الأجسام المضادة واستخدامها كأدوات اكتشاف دقيقة وحساسة تلتصق بالبروتين مباشرة.
بعد عملية السد، يتم احتضان الغشاء في محلول مخفف من الجسم المضاد الأولي (عادة بتركيز بين 0,5 ميكروغرام/مل إلى 5 ميكروغرام/مل) مع التحريك الخفيف. بشكله النموذجي، يحتوي المحلول على محاليل ملحية مع نسبة صغيرة من المنظفات، وأحياناً مسحوق حليب أو ألبومين مصل البقر BSA. يمكن وضع محلول الجسم المضاد والغشاء معاً وإحتضانهما لأي فترة بين 30 دقيقة إلى عبر الليل. ويمكن أيضاً إحتضانهما في درجات حرارة مختلفة، حيث تكون الدرجات الدافئة أكثر محفزة على الالتصاق (لكلا نوعي الالتصاق، الالتصاق المحدد والإلتصاق الغير محدد "التشويش").
بعد تنقيع الغشاء أو غسله لإزالة الأجسام المضادة الأولية الغير ملتصقة، يتم إضافة جسم مضاد آخر للغشاء، موجه نحو جزء خاص-لنوع species-specific الجسم المضاد الأولي. وهذا يعرف بالجسم المضاد الثانوي، وبسبب خواصه المستهدِفة، يتم تسميته بـ"ضد-الفأر"، "ضد-العنز"، "ضد-الجرذ"، الخ. الأجسام المضادة تأتي من مصادر الحيوانات (أو زراعة خلايا هيبريدوما حيوانية)؛ فالجسم المضاد الثانوي ضد-الفأر سيلتصق لأي جسم مضاد أولي مصدره الفأر. وهذا يسمح لتوفير المصاريف بالسماح لكل المختبر من استخدام مصدر واحد من جسم مضاد منتج بكثرة، ويوفر نتائج منسقة أكثر بكثير. عادة ما يكون الجسم المضاد الثانوي مرتبط بجزيئة بايوتين أو إلى إنزيم مراسل مثل فسفاتاز قلوي Alkaline phosphatase أو بيروكسيداز الفجل الحار Horseradish peroxidase. هذا يعني أن عدة أجسام مضادة ثانوية ستلتصق بجسم مضاد أولي واحد وتقوم بتعزيز الإشارة للاكتشاف.
غالباً ما يتم استخدام جسم مضاد ثانوي مرتبط ببيروكسيداز الفجل مع عامل مضيء كيميائي، وينتج التفاعل بينهما ضوءاً بمقدار كمية البروتين. يتم استخدام طبقة حساسة من الفيلم الفوتوغرافي لخلق صورة للأجسام المضادة الملتصقة باللطخة.
كما في إجراءات الإيلايزا الإيلايزبوت، يمكن تزويد الأنزيم بجزيئة التي يحولها الإنزيم إلى ناتج تفاعل ملون يمكن رؤيته على الغشاء.
البديل الثالث هو استخدام علامة مشعة بدل إنزيم متصل بالجسم المضاد الثانوي، مثل ربط بروتين يلتصق بالأجسام المضادة (مثل بروتين أ من العنقودية Staphylococcus) بنظير مشع من اليود. ولكن بما أنه الطرق الأخرى هي أكثر أماناً، وأسرع وأرخص، قلّ ما يتم استخدام هذه الطريقة الآن.
الخطوة الواحدة
تأريخياً، كانت عملية التحقق تُجرى بخطوتين وذلك بسبب السهولة النسبية لإنتاج أجسام مضادة أولية وثانوية من ناحية المرونة، وأيضاً يضيف خطوة تكبير للإشارة لعملية الاكتشاف.
نظراً للقدرة الإنتاجية العالية لتحليل البروتينات وإنخفاض حدود الإشارة المطلوبة للكشف، تم تطوير طرق تحقُّق ذات خطوة واحدة والتي تستطيع أن تحدث بصورة أسرع مع تقليل استخدام المستهلكات. وهذا يتطلب جسم مضاد ملتقط الذي يتعرف على البروتين المطلوب ويحتوي على علامات اكتشاف/التقاط، وغالباً ما يكون هناك ملتقطات للبروتينات المؤشرة Protein tags. يتم احتضان الملتقط الأولي مع الغشاء بطريقة مشابهة للجسم المضاد الأولي في طريقة الخطوتين، ومن ثم يكون جاهز للكشف بعد سلسلة من خطوات الغسل.
التحليل
بعد أن يتم غسل الملتقطات الغير ملتصقة، يصبح اللطخة الغربية جاهز للاكتشاف عن طريق الملتقطات الملتصقة بالبروتين المراد اكتشاف وجوده أو عدمه. في المصطلحات العملية، لا تُظهر كل اللطخات الغربية البروتين بصورة حزمة واحدة فقط على الغشاء. يتم أخذ تقديرات الحجم عن طريق مقارنة الحزم المكتشفة بحزم الدرج المصبوغة التي تم تحميلها عند خطوة الفصل الكهربائي. يتم إعادة هذه العملية لبروتين هيكلي، مثل الأكتين أو التيوبيولين، الذي لا يجب تغيير تركيزه بين العينات. كمية البروتين الموجودة تتم مقارنتها بالبروتين الهيكلي لكي يتم السيطرة على المجموعات العدة. هذه الطريقة تؤكد تصحيح التغييرات الدارجة بسبب عدم انتقال البروتين أو وجود أخطاء في التجربة.
الاكتشاف اللوني Colorimetric detection
طريقة الاكتشاف اللوني تعتمد على احتضان اللطخة الغربية مع المادة التي ستتفاعل مع الإنزيم المراسل (مثل البيروكسيداز Peroxidase) الذي يكون مرتبط بالجسم المضاد الثانوي. هذا يحول الصبغة الذائبة إلى شكل غير ذائب بلون مختلف والتي تترسب قرب الإنزيم وبالتالي تصبغ غشاء النيتروسيليلوز. يتم إيقاف تحميض اللطخة عندها عن طريق غسل الصبغة الذائبة. يتم تحليل كمية البروتينات باستخدام قياس الكثافة densitometry (أي ما هي كثافة البقعة/الصبغة) أو قياس الضوء spectrophotometry.
الإضاءة الكيميائية Chemiluminescence
تعتمد طريقة الاكتشاف بالإضاءة الكيميائية على احتضان اللطخة الغربية مع المادة التي تضيء عندما تتصل بالجزيء المراسل على الجسم المضاد الثانوي. وعندها يتم التقاط الضوء باستخدام فيلم فوتوغرافي، ومؤخراً باستخدام كاميرات سي سي دي CCD cameras تلتقط صورة رقمية لللطخة الغربية. هذه الصورة يتم تحليلها باستخدام مقياس الكثافة الذي يحلل كمية الصبغة البروتينية النسبية ويقوم بالتحليل الكمي عن طريق الكثافة الضوئية. يوجد برامج جديدة تساعد على تحليلات البيانات بصورة أخرى مثل تحليل الوزن الجزيئي إذا تم استخدام مقاييس صحيحة. يعتبر ما يسمى بالمضيء الكيميائي المحسن Enhanced chemiluminscent أو ECL هو من ضمن أكثر الطرق حساسية للاكتشاف التحليلي لللطخة الغربية.
الاكتشاف المشع Radioactive detection
العلامات المشعة لا تحتاج إلى مواد إنزيمية، ولكن فقط وضع أفلام أشعة سينية طبية مباشرة على اللطخة الغربية والذي يقوم بخلق أجزاء غامقة على الفيلم تعود إلى حزم البروتينات المطلوب كشفها (انظر الصورة). قلت أهمية طرق الاكتشاف المشع، بسبب كونها مكلفة، ولها أخطار صحية عالية، كما أن المضيء الكيميائي المحسن ECL يعتبر بدل مفيد جداً.
الاكتشاف الفلوري Fluorescent detection
يتم تحفيز الملتقط ذو العلامات الفلورية بواسطة الضوء والانبعاث من التحفيز وبذلك يتم الاستدلال عليه بواسطة متحسس ضوئي مثل كاميرا سي سي دي المزودة بمرشح باعث مناسب حيث يقوم بألتقاط الصورة الرقمية لللطخة الغربية ويقوم بالسماح لتحليل بيانات أخرى كالوزن الجزيئي والتحليل الكمي لللطخة الغربية. يعتبر الملتقط الفلوري من بين أكثر الطُرق حساسية لتحليل اللطخة.
التحقق الثانوي
أحد الاختلافات الكبيرة بين غشائي النيتروسيليلوز و PVDF يعود إلى قابلية كل منهم على القيام بـ"تعرية" للأجسام المضادة وإعادة الاستخدام لأجسام مضادة ملتقطة لاحقاً. وبالرغم من أن هناك طرق مختبرة لتعرية أغشية النيتروسيليلوز، تظل أغشية الـPVDF أسهل تعرية، وتسهل استخدام أكثر قبل أن يقوم التشويش الخلفي بإعاقة التجارب. أحد الاختلافات الأخرى هو، بعكس النيتروسيليلوز، الـPVDF يجب أن ينقع في 95% إيثانول، بروبانول أو ميثانول قبل الاستخدام. أغشية الـPVDF أيضاً تكون أكثر سمكاً وأكثر مقاومة للضرر خلال الاستخدام.
الفصل الكهربائي للهلام ببعدين
2D-SDS-PAGE ثنائي الأبعاد يستعمل المبادئ والتقنيات المُشار إليها اعلاه. كما يشير الاسم، فإن هذه الطريقة تشمل هجرة سلسلة البروتينات في بعدين. في البُعد الأول تقوم السلسلة البروتينية بالأنفصال حسب نقطة التعادل الكهربي. أما في البعد الثاني تنفصل السلسلة البروتينية حسب وزنها الجزيئي. تُقاس نقطة التعادل الكهربي لبروتين مُعين بواسطة الرقم النسبي للأحماض الأمينية الموجبة (كاللايسين) والسالبة (كالگلوتاميت), وتقوم الأحماض الأمينية السالبة بتزويد أعلى نقطة تعادل كهربي, ومن جهة أخرى تقوم الأحماض الامينية الموجبة بتزويد أقل نقطة تعادل كهربي.
تسمح هذه الطريقة بفصل كل البروتينات الخلوية على هلام مفرد وكبير. من الفوائد المهمة لهذه الطريقة هي التمييز بين الأشكال المُختلفة لبروتين مُعين (مثلاَ البروتين الذي تمت فسفرتهُ، أي إضافة المجموعة السالبة الشُحنة). يُمكن قطع البروتين الذي تم فَصله من الهُلام وبعدها يتم تحليله بواسطة جهاز تحليل الكتلة mass spectrometry الذي يقوم باكتشاف البروتين وتحديد هويته.
الاستخدامات في الفحص الطبي
- إحدى اختيارات الكشف على فيروس نقص المناعة البشرية توظف اللطخة الغربية لاكتشاف الجسم المضاد للفيروس HIV في عينة مصل الإنسان. بروتينات من خلايا معروفة الإصابة بفيروس HIV يتم فصلها وبقعها على غشاء كما في أعلاه. ثم، يتم تجربة المصل بصورة جسم مضاد أولي؛ ثم يتم غسل الأجسام المضادة غير الملتصقة، ويتم وضع جسم مضاد ثانوي ضد-بشري مرتبط بإنزيم الإشارة. الحزم المصبوغة تدل على البروتينات التي تتعرف عليها الأجسام المضادة في مصل المريض.
- يتم أيضاً استخدام اللطخة الغربية كاختيار مؤكد لمرض جنون البقر (Bovine spongiform encephalopathy (BSE.
- يتم استخدام اللطخة الغربية لاختيار بعض أنواع مرض لايم Lyme disease (الذي هو التهاب بكتيري).
الطرق
المصادر
- ^ W. Neal Burnette (1981). "'Western blotting': electrophoretic transfer of proteins from sodium dodecyl sulfate — polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A". Anal Biochem. 112 (2): 195–203.
{{cite journal}}: Unknown parameter|month=ignored (help) PMID: 6266278 doi:10.1016/0003-2697(81)90281-5 - ^ Citation's Classic: Burnette
- ^ Renart J, Reiser J, Stark GR. "Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure", Proc Natl Acad Sci U S A, 1979 Jul;76(7):3116-20. PMID: 91164 abstract
- ^ Towbin H, Staehelin T, Gordon J. "Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications" Proc Natl Acad Sci U S A, 1979 Sep;76(9):4350-4. PMID: 388439 abstract