أوزون

| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Ozone
| |||
| اسم أيوپاك النظامي
Trioxygen | |||
| أسماء أخرى
2λ4-trioxidiene; catena-trioxygen
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.051 | ||
| رقم EC |
| ||
| مرجع Gmelin | 1101 | ||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | O3 | ||
| كتلة مولية | 47.98 g mol-1 | ||
| المظهر | Colourless to pale blue gas[1] | ||
| الرائحة | Pungent, metallic, dry[1] | ||
| الكثافة | 2.144 g/L (at 0 °C) | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 1.05 g L−1 (at 0 °C) | ||
| قابلية الذوبان في other solvents | Very soluble in CCl4, sulfuric acid | ||
| ضغط البخار | 55.7 atm[2] (−12.15 °C أو 10.13 °F أو 261.00 K)[أ] | ||
| القابلية المغناطيسية | +6.7·10−6 cm3/mol | ||
| معامل الانكسار (nD) | 1.2226 (liquid), 1.00052 (gas, STP, 546 nm—note high dispersion)[3] | ||
| البنية | |||
| الزمرة الفراغية | C2v | ||
| هندسة إحداثية |
Digonal | ||
| الشكل الجزيئي | Dihedral | ||
| تهجين | sp2 for O1 | ||
| Dipole moment | 0.53 D | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
142.67 kJ mol−1 | ||
| Standard molar entropy S |
238.92 J K−1 mol−1 | ||
| المخاطر | |||
| ن.م.ع. مخطط تصويري |        
| ||
| ن.م.ع. كلمة الاشارة | Danger | ||
| H270, H314, H330, H335, H341, H361, H370, H410 | |||
| P203, P220, P244, P260, P264+P265, P270, P271, P273, P280, P284, P301+P330+P331, P302+P361+P354, P304+P340, P305+P351+P338, P308+P316, P362+P364, P370+P376, P391, P403+P233, P405 | |||
| NFPA 704 (معيـَّن النار) | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LCLo (المنشورة الأقل)
|
12.6 ppm (mouse, 3 hr) 50 ppm (human, 30 min) 36 ppm (rabbit, 3 hr) 21 ppm (mouse, 3 hr) 21.8 ppm (rat, 3 hr) 24.8 ppm (guinea pig, 3 hr) 4.8 ppm (rat, 4 hr)[4] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 0.1 ppm (0.2 mg/m3)[1] | ||
REL (الموصى به)
|
C 0.1 ppm (0.2 mg/m3)[1] | ||
IDLH (خطر عاجل)
|
5 ppm[1] | ||
| مركبات ذا علاقة | |||
مركـّبات ذات علاقة
|
Sulfur dioxide Trisulfur Disulfur monoxide Cyclic ozone | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
الأوزون ( Ozone ؛ /ˈoʊzoʊn/ (![]() استمع))، ويُسمى أيضاً الأكسجين الثلاثي trioxygen، هو جزيء غير عضوي غاز شفاف يتكون من ثلاث ذرات من الأكسجين صيغته الكيميائية O 3. وهو غاز أزرق شاحب ذو رائحة نفاذة. It is an allotrope of oxygen that is much less stable than the diatomic allotrope O 2, breaking down in the lower atmosphere to O 2 (dioxygen). Ozone is formed from dioxygen by the action of ultraviolet (UV) light and electrical discharges within the Earth's atmosphere. It is present in very low concentrations throughout the atmosphere, with its highest concentration high in the ozone layer of the stratosphere, which absorbs most of the Sun's ultraviolet (UV) radiation.
استمع))، ويُسمى أيضاً الأكسجين الثلاثي trioxygen، هو جزيء غير عضوي غاز شفاف يتكون من ثلاث ذرات من الأكسجين صيغته الكيميائية O 3. وهو غاز أزرق شاحب ذو رائحة نفاذة. It is an allotrope of oxygen that is much less stable than the diatomic allotrope O 2, breaking down in the lower atmosphere to O 2 (dioxygen). Ozone is formed from dioxygen by the action of ultraviolet (UV) light and electrical discharges within the Earth's atmosphere. It is present in very low concentrations throughout the atmosphere, with its highest concentration high in the ozone layer of the stratosphere, which absorbs most of the Sun's ultraviolet (UV) radiation.
Ozone's odour is reminiscent of chlorine, and detectable by many people at concentrations of as little as 0.1 ppm in air. Ozone's O3 structure was determined in 1865. The molecule was later proven to have a bent structure and to be weakly diamagnetic. At standard temperature and pressure, ozone is a pale blue gas that condenses at cryogenic temperatures to a dark blue liquid and finally a violet-black solid. Ozone's instability with regard to more common dioxygen is such that both concentrated gas and liquid ozone may decompose explosively at elevated temperatures, physical shock, or fast warming to the boiling point.[5][6] It is therefore used commercially only in low concentrations.
Ozone is a powerful oxidising agent (far more so than dioxygen) and has many industrial and consumer applications related to oxidation. This same high oxidising potential, however, causes ozone to damage mucous and respiratory tissues in animals, and also tissues in plants, above concentrations of about 0.1 ppm. While this makes ozone a potent respiratory hazard and pollutant near ground level, a higher concentration in the ozone layer (from two to eight ppm) is beneficial, preventing damaging UV light from reaching the Earth's surface.
التسمية
The trivial name ozone is the most commonly used and preferred IUPAC name. The systematic names 2λ4-trioxidiene[محل شك] and catena-trioxygen, valid IUPAC names, are constructed according to the substitutive and additive nomenclatures, respectively. The name ozone derives from ozon (ὄζον), the Greek neuter present participle of ozein (ὄζειν) "to smell",[7] referring to ozone's distinctive smell.
In appropriate contexts, ozone can be viewed as trioxidane with two hydrogen atoms removed, and as such, trioxidanylidene may be used as a systematic name, according to substitutive nomenclature. By default, these names pay no regard to the radicality of the ozone molecule. In an even more specific context, this can also name the non-radical singlet ground state, whereas the diradical state is named trioxidanediyl.
Trioxidanediyl (or ozonide) is used, non-systematically, to refer to the substituent group (-OOO-). Care should be taken to avoid confusing the name of the group for the context-specific name for the ozone given above.
التاريخ

في 1785، كان الكيميائي الهولندي Martinus van Marum يجري تجارب تستخدم electrical sparking above water when he noticed an unusual smell, which he attributed to the electrical reactions, failing to realize that he had in fact produced ozone.[8][9]
وبعد نصف قرن، لاحظ الكيميائي الألماني كريستيان فريدريك شونباين نفس الرائحة النفاذة وتعرف على أنها الرائحة التي كثيراً ما تلي صاعقة برق. وفي 1839، نجح في عزل المادة الكيميائية الغازية وأسماها "أوزون"، من الكلمة اليونانية ozein (ὄζειν) meaning "to smell".[10][11] For this reason, Schönbein is generally credited with the discovery of ozone.[12][13][14][8] He also noted the similarity of ozone smell to the smell of phosphorus, and in 1844 proved that the product of reaction of white phosphorus with air is identical.[10] A subsequent effort to call ozone "electrified oxygen" he ridiculed by proposing to call the ozone from white phosphorus "phosphorized oxygen".[10] The chemical formula for ozone, O3, was not determined until 1865 by Jacques-Louis Soret[15] and confirmed by Schönbein in 1867.[10][16]
For much of the second half of the 19th century and well into the 20th, ozone was considered a healthy component of the environment by naturalists and health-seekers. Beaumont, California, had as its official slogan "Beaumont: Zone of Ozone", as evidenced on postcards and Chamber of Commerce letterhead.[17] Naturalists working outdoors often considered the higher elevations beneficial because of their ozone content which was readily monitored.[18] "There is quite a different atmosphere [at higher elevation] with enough ozone to sustain the necessary energy [to work]", wrote naturalist Henry Henshaw, working in Hawaii.[19] Seaside air was considered to be healthy because of its believed ozone content. The smell giving rise to this belief is in fact that of halogenated seaweed metabolites[20] and dimethyl sulfide.[21]
Much of ozone's appeal seems to have resulted from its "fresh" smell, which evoked associations with purifying properties. Scientists noted its harmful effects. In 1873 James Dewar and John Gray McKendrick documented that frogs grew sluggish, birds gasped for breath, and rabbits' blood showed decreased levels of oxygen after exposure to "ozonized air", which "exercised a destructive action".[22][12] Schönbein himself reported that chest pains, irritation of the mucous membranes, and difficulty breathing occurred as a result of inhaling ozone, and small mammals died.[23] In 1911, Leonard Hill and Martin Flack stated in the Proceedings of the Royal Society B that ozone's healthful effects "have, by mere iteration, become part and parcel of common belief; and yet exact physiological evidence in favour of its good effects has been hitherto almost entirely wanting ... The only thoroughly well-ascertained knowledge concerning the physiological effect of ozone, so far attained, is that it causes irritation and œdema of the lungs, and death if inhaled in relatively strong concentration for any time."[12][24]
During World War I, ozone was tested at Queen Alexandra Military Hospital in London as a possible disinfectant for wounds. The gas was applied directly to wounds for as long as 15 minutes. This resulted in damage to both bacterial cells and human tissue. Other sanitizing techniques, such as irrigation with antiseptics, were found preferable.[12][25]
Until the 1920s, it was not certain whether small amounts of oxozone, O 4, were also present in ozone samples due to the difficulty of applying analytical chemistry techniques to the explosive concentrated chemical.[26][27] In 1923, Georg-Maria Schwab (working for his doctoral thesis under Ernst Hermann Riesenfeld) was the first to successfully solidify ozone and perform accurate analysis which conclusively refuted the oxozone hypothesis.[26][27] Further hitherto unmeasured physical properties of pure concentrated ozone were determined by the Riesenfeld group in the 1920s.[26]
الخصائص الطبيعية
Ozone is a colourless or pale blue gas, slightly soluble in water, and much more soluble in inert non-polar solvents such as carbon tetrachloride or fluorocarbons, in which it forms a blue solution. At 161 K (−112 °C; −170 °F), it condenses to form a dark blue liquid. It is dangerous to allow this liquid to warm to its boiling point, because both concentrated gaseous ozone and liquid ozone can detonate. At temperatures below 80 K (−193.2 °C; −315.7 °F), it forms a violet-black solid.[28]
Ozone has a very specific sharp odour somewhat resembling chlorine bleach. Most people can detect it at the 0.01 μmol/mol level in air. Exposure of 0.1 to 1 μmol/mol produces headaches and burning eyes and irritates the respiratory passages.[29] Even low concentrations of ozone in air are very destructive to organic materials such as latex, plastics, and animal lung tissue.
The ozone molecule is weakly diamagnetic.[30]
البنية
According to experimental evidence from microwave spectroscopy, ozone is a bent molecule, with C2v symmetry (similar to the water molecule).[31] The O–O distances are 127.2 pm (1.272 Å). The O–O–O angle is 116.78°.[32] The central atom is sp² hybridized with one lone pair. Ozone is a polar molecule with a dipole moment of 0.53 D.[33] The molecule can be represented as a resonance hybrid with two contributing structures, each with a single bond on one side and double bond on the other. The arrangement possesses an overall bond order of 1.5 for both sides. It is isoelectronic with the nitrite anion. Naturally occurring ozone can be composed of substituted isotopes (16O, 17O, 18O). A cyclic form has been predicted but not observed.
التفاعلات
Ozone is among the most powerful oxidising agents known, far stronger than O
2. It is also unstable at high concentrations, decaying into ordinary diatomic oxygen. Its half-life varies with atmospheric conditions such as temperature, humidity, and air movement. Under laboratory conditions, the half-life will average ~1500 minutes (25 hours) in still air at room temperature (24 °C), zero humidity with zero air changes per hour.[34]
This reaction proceeds more rapidly with increasing temperature. Deflagration of ozone can be triggered by a spark and can occur in ozone concentrations of 10 wt% or higher.[35]
Ozone can also be produced from oxygen at the anode of an electrochemical cell. This reaction can create smaller quantities of ozone for research purposes.[36]
This can be observed as an unwanted reaction in a Hoffman apparatus during the electrolysis of water when the voltage is set above the necessary voltage.
With metals
Ozone oxidises most metals (except gold, platinum, and iridium) into oxides of the metals in their highest oxidation state. For example:
With nitrogen and carbon compounds
Ozone oxidises nitric oxide to nitrogen dioxide:
This reaction is accompanied by chemiluminescence.
The NO
2 can be further oxidised to nitrate radical:
The NO
3 formed can react with NO
2 to form dinitrogen pentoxide (N
2O
5).
Solid nitronium perchlorate can be made from NO
2, ClO
2, and O
3 gases:
Ozone does not react with ammonium salts, but it oxidises ammonia to ammonium nitrate:
Ozone reacts with carbon to form carbon dioxide, even at room temperature:
With sulphur compounds
Ozone oxidizes sulphides to sulphates. For example, lead(II) sulphide is oxidized to lead(II) sulphate:
Sulphuric acid can be produced from ozone, water and either elemental sulphur or sulphur dioxide:
In the gas phase, ozone reacts with hydrogen sulphide to form sulphur dioxide:
In an aqueous solution, however, two competing simultaneous reactions occur, one to produce elemental sulphur, and one to produce sulphuric acid:
With alkenes and alkynes
Alkenes can be oxidatively cleaved by ozone, in a process called ozonolysis, giving alcohols, aldehydes, ketones, and carboxylic acids, depending on the second step of the workup.
Ozone can also cleave alkynes to form an acid anhydride or diketone product.[38] If the reaction is performed in the presence of water, the anhydride hydrolyzes to give two carboxylic acids.
Usually ozonolysis is carried out in a solution of dichloromethane, at a temperature of −78 °C. After a sequence of cleavage and rearrangement, an organic ozonide is formed. With reductive workup (e.g. zinc in acetic acid or dimethyl sulphide), ketones and aldehydes will be formed, with oxidative workup (e.g. aqueous or alcoholic hydrogen peroxide), carboxylic acids will be formed.[39]
Other substrates
All three atoms of ozone may also react, as in the reaction of tin(II) chloride with hydrochloric acid and ozone:
Iodine perchlorate can be made by treating iodine dissolved in cold anhydrous perchloric acid with ozone:
Ozone can also react with potassium iodide to give oxygen and iodine gas that can be titrated for quantitative determination:[40]
Combustion
Ozone can be used for combustion reactions and combustible gases; ozone provides higher temperatures than burning in dioxygen (O
2). The following is a reaction for the combustion of carbon subnitride which can also cause higher temperatures:
Ozone can react at cryogenic temperatures. At 77 K (−196.2 °C; −321.1 °F), atomic hydrogen reacts with liquid ozone to form a hydrogen superoxide radical, which dimerizes:[41]
Ozone decomposition
Types of ozone decomposition
Ozone is a toxic substance,[42][43] commonly found or generated in human environments (aircraft cabins, offices with photocopiers, laser printers, sterilisers, ...).
The catalytic decomposition of ozone is very important to reduce pollution. This type of decomposition is the most widely used, especially with solid catalysts, and it has many advantages such as a higher conversion with a lower temperature. Furthermore, the product and the catalyst can be instantaneously separated, and this way the catalyst can be easily recovered without using any separation operation. The most-used materials in the catalytic decomposition of ozone in the gas phase are manganese dioxide, transition metals such as Mn, Co, Cu, Fe, Ni, or Ag, and noble metals such as Pt, Rh, or Pd.
Free radicals of chlorine (Cl·), formed by the action of ultraviolet radiation on chlorofluorocarbons (CFCs) and sea salt, are known to catalyse the breakdown of ozone in the atmosphere.
There are two other possibilities for decomposing ozone in the gas phase:
- Thermal decomposition, in which the ozone is decomposed using only the action of heat. The problem is that this type of decomposition is very slow with temperatures below 250 °C. However, the decomposition rate can be increased working with higher temperatures but this would involve a high energy cost.
- Photochemical decomposition, which consists of radiating ozone with ultraviolet radiation (UV) and it gives rise to oxygen and radical peroxide.[44]
Kinetics of ozone decomposition into molecular oxygen
The uncatalysed process of ozone decomposition in the gas phase is a complex reaction involving two elementary reactions that finally lead to molecular oxygen,[45] and this means that the reaction order and the rate law cannot be determined by the stoichiometry of the overall reaction.
Overall reaction:
Rate law (observed):
where is the observed rate constant and is the reaction rate. From the rate law above it can be determined that the partial order respect to molecular oxygen is −1 and respect to ozone is 2; therefore, the global reaction order is 1.
The first step is a unimolecular reaction wherein one molecule of ozone decomposes into two products (molecular oxygen and oxygen). The oxygen atom from the first step is a reactive intermediate because it participates as a reactant in the second step, which is a bimolecular reaction because there are two different reactants (ozone and oxygen) that give rise to molecular oxygen.
Step 1: Unimolecular reaction
Step 2: Bimolecular reaction
These two steps have different reaction rates and rate constants. The reaction rate laws for each of these steps are shown below:
The following mechanism allows to explain the rate law of the ozone decomposition observed experimentally, and also it allows to determine the reaction orders with respect to ozone and oxygen, with which the overall reaction order will be determined.
The first step is assumed reversible and faster than the second reaction, which means that the slower rate determining step is the second reaction. This step determines the rate of product formation, and so . However, this equation depends on the concentration of oxygen (intermediate), which does not appear in the observed rate law. Since the first step is a rapid equilibrium, the concentration of the intermediate can be determined as follows:
Then using these equations, the formation rate of molecular oxygen is as shown below:
The mechanism is consistent with the rate law observed experimentally if the rate constant (Kobs) is given in terms of the individual mechanistic steps' rate constants as follows:[46]
where
Reduction to ozonides
Reduction of ozone gives the ozonide anion, O−
3. Derivatives of this anion are explosive and must be stored at cryogenic temperatures. Ozonides for all the alkali metals are known. KO
3, RbO
3, and CsO
3 can be prepared from their respective superoxides:
Although KO
3 can be formed as above, it can also be formed from potassium hydroxide and ozone:[47]
NaO
3 and LiO
3 must be prepared by action of CsO
3 in liquid NH
3 on an ion-exchange resin containing Na+
or Li+
ions:[48]
A solution of calcium in ammonia reacts with ozone to give ammonium ozonide and not calcium ozonide:[41]
Applications
Ozone can be used to remove iron and manganese from water, forming a precipitate which can be filtered:
Ozone oxidizes dissolved hydrogen sulphide in water to sulphurous acid:
These three reactions are central in the use of ozone-based well-water treatment.
Ozone detoxifies cyanides by converting them to cyanates.
Ozone completely decomposes urea:[49]
الخصائص المطيافية
Ozone is a bent triatomic molecule with three vibrational modes: the symmetric stretch (1103.157 cm−1), bend (701.42 cm−1) and antisymmetric stretch (1042.096 cm−1).[50] The symmetric stretch and bend are weak absorbers, but the antisymmetric stretch is strong and responsible for ozone being an important minor greenhouse gas. This IR band is also used to detect ambient and atmospheric ozone although UV-based measurements are more common.[51]
The electromagnetic spectrum of ozone is quite complex. An overview can be seen at the MPI Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest.[52]
All of the bands are dissociative, meaning that the molecule falls apart to O + O2 after absorbing a photon. The most important absorption is the Hartley band, extending from slightly above 300 nm down to slightly above 200 nm. It is this band that is responsible for absorbing UV C in the stratosphere.
On the high wavelength side, the Hartley band transitions to the so-called Huggins band, which falls off rapidly until disappearing by ~360 nm. Above 400 nm, extending well out into the NIR, are the Chappius and Wulf bands. There, unstructured absorption bands are useful for detecting high ambient concentrations of ozone, but are so weak that they do not have much practical effect.
There are additional absorption bands in the far UV, which increase slowly from 200 nm down to reaching a maximum at ~120 nm.
الأوزون في الغلاف الجوي للأرض

The standard way to express total ozone levels (the amount of ozone in a given vertical column) in the atmosphere is by using Dobson units. Point measurements are reported as mole fractions in nmol/mol (parts per billion, ppb) or as concentrations in μg/m3. The study of ozone concentration in the atmosphere started in the 1920s.[53]
طبقة الأوزون
الموقع والانتاج
The highest levels of ozone in the atmosphere are in the stratosphere, in a region also known as the ozone layer between about 10 and 50 km above the surface (or between about 6 and 31 miles). However, even in this "layer", the ozone concentrations are only two to eight parts per million, so most of the oxygen there is dioxygen, O2, at about 210,000 parts per million by volume.[54]
Ozone in the stratosphere is mostly produced from short-wave ultraviolet rays between 240 and 160 nm. Oxygen starts to absorb weakly at 240 nm in the Herzberg bands, but most of the oxygen is dissociated by absorption in the strong Schumann–Runge bands between 200 and 160 nm where ozone does not absorb. While shorter wavelength light, extending to even the X-Ray limit, is energetic enough to dissociate molecular oxygen, there is relatively little of it, and, the strong solar emission at Lyman-alpha, 121 nm, falls at a point where molecular oxygen absorption is a minimum.[55]
The process of ozone creation and destruction is called the Chapman cycle and starts with the photolysis of molecular oxygen
followed by reaction of the oxygen atom with another molecule of oxygen to form ozone.
where "M" denotes the third body that carries off the excess energy of the reaction. The ozone molecule can then absorb a UV-C photon and dissociate
The excess kinetic energy heats the stratosphere when the O atoms and the molecular oxygen fly apart and collide with other molecules. This conversion of UV light into kinetic energy warms the stratosphere. The oxygen atoms produced in the photolysis of ozone then react back with other oxygen molecule as in the previous step to form more ozone. In the clear atmosphere, with only nitrogen and oxygen, ozone can react with the atomic oxygen to form two molecules of O
2:
An estimate of the rate of this termination step to the cycling of atomic oxygen back to ozone can be found simply by taking the ratios of the concentration of O2 to O3. The termination reaction is catalysed by the presence of certain free radicals, of which the most important are hydroxyl (OH), nitric oxide (NO) and atomic chlorine (Cl) and bromine (Br). In the second half of the 20th century, the amount of ozone in the stratosphere was discovered to be declining, mostly because of increasing concentrations of chlorofluorocarbons (CFC) and similar chlorinated and brominated organic molecules. The concern over the health effects of the decline led to the 1987 Montreal Protocol, the ban on the production of many ozone-depleting chemicals and in the first and second decade of the 21st century the beginning of the recovery of stratospheric ozone concentrations.
Importance to surface-dwelling life on Earth

Ozone in the ozone layer filters out sunlight wavelengths from about 200 nm UV rays to 315 nm, with ozone peak absorption at about 250 nm.[56] This ozone UV absorption is important to life, since it extends the absorption of UV by ordinary oxygen and nitrogen in air (which absorb all wavelengths < 200 nm) through the lower UV-C (200–280 nm) and the entire UV-B band (280–315 nm). The small unabsorbed part that remains of UV-B after passage through ozone causes sunburn in humans, and direct DNA damage in living tissues in both plants and animals. Ozone's effect on mid-range UV-B rays is illustrated by its effect on UV-B at 290 nm, which has a radiation intensity 350 million times as powerful at the top of the atmosphere as at the surface. Nevertheless, enough of UV-B radiation at similar frequency reaches the ground to cause some sunburn, and these same wavelengths are also among those responsible for the production of vitamin D in humans.
The ozone layer has little effect on the longer UV wavelengths called UV-A (315–400 nm), but this radiation does not cause sunburn or direct DNA damage. While UV-A probably does cause long-term skin damage in certain humans, it is not as dangerous to plants and to the health of surface-dwelling organisms on Earth in general (see ultraviolet for more information on near ultraviolet).
Ground-level ozone
| جزء من سلسلة عن |
| التلوث |
|---|
 |
|
|
Ground-level ozone (or tropospheric ozone) is an atmospheric pollutant.[57] It is not emitted directly by car engines or by industrial operations, but formed by the reaction of sunlight on air containing hydrocarbons and nitrogen oxides that react to form ozone directly at the source of the pollution or many kilometres downwind.
Ozone reacts directly with some hydrocarbons such as aldehydes and thus begins their removal from the air, but the products are themselves key components of smog. Ozone photolysis by UV light leads to production of the hydroxyl radical HO• and this plays a part in the removal of hydrocarbons from the air, but is also the first step in the creation of components of smog such as peroxyacyl nitrates, which can be powerful eye irritants. The atmospheric lifetime of tropospheric ozone is about 22 days; its main removal mechanisms are being deposited to the ground, the above-mentioned reaction giving HO•, and by reactions with OH and the peroxy radical HO2•.[58]
There is evidence of significant reduction in agricultural yields because of increased ground-level ozone and pollution which interferes with photosynthesis and stunts overall growth of some plant species.[59][60] The United States Environmental Protection Agency (EPA) has proposed a secondary regulation to reduce crop damage, in addition to the primary regulation designed for the protection of human health.
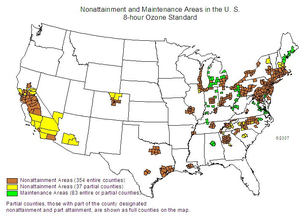
Ground-level ozone in urban areas
Certain examples of cities with elevated ozone readings are Denver, Colorado; Houston, Texas; and Mexico City, Mexico. Houston has a reading of around 41 nmol/mol, while Mexico City is far more hazardous, with a reading of about 125 nmol/mol.[60]
Ground-level ozone, or tropospheric ozone, is the most concerning type of ozone pollution in urban areas and is increasing in general.[61] Ozone pollution in urban areas affects denser populations, and is worsened by high populations of vehicles, which emit NO2 and volatile organic compounds (VOCs), the main pollutants contributing to problematic ozone levels.[62] Ozone pollution in urban areas is especially concerning with increasing temperatures, raising heat-related mortality during heat waves.[63] During heat waves in urban areas, ground level ozone pollution can be 20% higher than usual.[64] Ozone pollution in urban areas reaches higher levels of exceedance in the summer and autumn, which may be explained by patterns of weather and traffic.[62] People experiencing poverty are more affected by pollution in general, even though these populations are less likely to be contributing to pollution levels.[65]
As mentioned above, Denver, Colorado, is one of the many cities in the U.S. that have high amounts of ozone. According to the American Lung Association, the Denver–Aurora area is the 14th most ozone-polluted area in the U.S.[66] The problem of high ozone levels is not new to this area. In 2004, the EPA allotted the Denver Metro/North Front Range[ب] as non-attainment areas per 1997's 8-hour ozone standard,[67] but later deferred this status until 2007. The non-attainment standard indicates that an area does not meet the EPA's air quality standards. The Colorado Ozone Action Plan was created in response, and numerous changes were implemented from this plan. The first major change was that car emission testing was expanded across the state to more counties that did not previously mandate emissions testing, like areas of Larimer and Weld County. There have also been changes made to decrease emissions of nitrogen oxides (NOx) and VOCs, which should help lower ozone levels.
One large contributor to high ozone levels in the area is the oil and natural gas industry situated in the Denver-Julesburg Basin (DJB) which overlaps with a majority of Colorado's metropolitan areas. Ozone is produced naturally in the Earth's stratosphere, but is also produced in the troposphere from human efforts. Briefly mentioned above, NOx and VOCs react with sunlight to create ozone through a process called photochemistry. One hour elevated ozone events (<75 ppb) "occur during June–August indicating that elevated ozone levels are driven by regional photochemistry".[68] According to an article from the University of Colorado-Boulder, "Oil and natural gas VOC emission have a major role in ozone production and bear the potential to contribute to elevated O3 levels in the Northern Colorado Front Range (NCFR)".[68] Using complex analyses to research wind patterns and emissions from large oil and natural gas operations, the authors concluded that "elevated O3 levels in the NCFR are predominantly correlated with air transport from N– ESE, which are the upwind sectors where the O&NG operations in the Wattenberg Field area of the DJB are located".[68]
Contained in the Colorado Ozone Action Plan, created in 2008, plans exist to evaluate "emission controls for large industrial sources of NOx" and "statewide control requirements for new oil and gas condensate tanks and pneumatic valves".[69] In 2011, the Regional Haze Plan was released that included a more specific plan to help decrease NOx emissions. These efforts are increasingly difficult to implement and take many years to come to pass. Of course there are also other reasons that ozone levels remain high. These include: a growing population meaning more car emissions, and the mountains along the NCFR that can trap emissions. If interested, daily air quality readings can be found at the Colorado Department of Public Health and Environment's website.[70] As noted earlier, Denver continues to experience high levels of ozone to this day. It will take many years and a systems-thinking approach to combat this issue of high ozone levels in the Front Range of Colorado.
Ozone cracking

Ozone gas attacks any polymer possessing olefinic or double bonds within its chain structure, such as natural rubber, nitrile rubber, and styrene-butadiene rubber. Products made using these polymers are especially susceptible to attack, which causes cracks to grow longer and deeper with time, the rate of crack growth depending on the load carried by the rubber component and the concentration of ozone in the atmosphere. Such materials can be protected by adding antiozonants, such as waxes, which bond to the surface to create a protective film or blend with the material and provide long term protection. Ozone cracking used to be a serious problem in car tyres,[71] for example, but it is not an issue with modern tyres. On the other hand, many critical products, like gaskets and O-rings, may be attacked by ozone produced within compressed-air systems. Fuel lines made of reinforced rubber are also susceptible to attack, especially within the engine compartment, where some ozone is produced by electrical components. Storing rubber products in close proximity to a DC electric motor can accelerate ozone cracking. The commutator of the motor generates sparks which in turn produce ozone.
Ozone as a greenhouse gas

Although ozone was present at ground level before the Industrial Revolution, peak concentrations are now far higher than the pre-industrial levels, and even background concentrations well away from sources of pollution are substantially higher.[73][74] Ozone acts as a greenhouse gas, absorbing some of the infrared energy emitted by the earth. Quantifying the greenhouse gas potency of ozone is difficult because it is not present in uniform concentrations across the globe. However, the most widely accepted scientific assessments relating to climate change (e.g. the Intergovernmental Panel on Climate Change Third Assessment Report)[75] suggest that the radiative forcing of tropospheric ozone is about 25% that of carbon dioxide.
The annual global warming potential of tropospheric ozone is between 918 and 1022 tons carbon dioxide equivalent/tons tropospheric ozone. This means on a per-molecule basis, ozone in the troposphere has a radiative forcing effect roughly 1,000 times as strong as carbon dioxide. However, tropospheric ozone is a short-lived greenhouse gas, which decays in the atmosphere much more quickly than carbon dioxide. This means that over a 20-year span, the global warming potential of tropospheric ozone is much less, roughly 62 to 69 tons carbon dioxide equivalent / ton tropospheric ozone.[76]
Because of its short-lived nature, tropospheric ozone does not have strong global effects, but has very strong radiative forcing effects on regional scales. In fact, there are regions of the world where tropospheric ozone has a radiative forcing up to 150% of carbon dioxide.[77] For example, ozone increase in the troposphere is shown to be responsible for ~30% of upper Southern Ocean interior warming between 1955 and 2000.[78]
التواجد
 مقالة مفصلة: وقت صلاة الصبح يمتلأ الجو بأعلى نسبة من غاز الأوزون
مقالة مفصلة: وقت صلاة الصبح يمتلأ الجو بأعلى نسبة من غاز الأوزون
يوجد الأوزون طبيعياً في طبقة الستراتوسفير ويرجع وجودة إلى سلسلة من التفاعلات بين الأكسجين الجزئى و الذرى ولايبقى الأوزون المتكون لفترة وجيزه ثم يتفكك بفعل ضوء الشمس إلى أكسجين جزئى ثم يتكون وفى النهاية نحصل على شكل يبقى دائماً على طبقة من الأوزون في منطقة الستراتوسفير متوازنة وهذا التوازون يعتمد على سرعة تكوينه وسرعة تفكك الأوزون وعندما يحدث تداخل لبعض المواد مع هذة السرعة نحصل على خلل إما في زيادة تركيز الأوزون أو بالعكس إزالة الاوزون من الستراتوسفير .
الأوزون شكل من الأكسجين الموجود بكميات قليلة في طبقات الجو المحيطة بالأرض. ويُعدّ وجود الأوزون في الطبقة العليا من الجو عاملاً رئيسيًا للحفاظ على الحياة على الأرض. أما وجود الأوزون في الطبقة السفلى من الجو فيؤدي إلى تلوث الهواء. ويستخدم الأوزون في بعض الصناعات، كتنقية المياه والتبييض.
تحتوي جزيئات الأكسجين العادية على ذرتين من الأكسجين، أما جزيئات الأوزون فإنها تحتوي على ثلاث ذرات من الأكسجين.
يتكون الأوزون طبيعيًا عن طريق التفاعلات الضوئية الكيميائية والتفريغ الكهربائي. يتكون الأوزون عن طريق التفاعل الضوئي الكيميائي عندما يرتطم إشعاع شمس ذو قوة عالية بالأكسجين العادي في الطبقة العليا من جو الأرض، ويحول بعضًا منه إلى أوزون.
وكذلك تقوم تفاعلات التفريغ الكهربائي بما فيها البرق والشرارات الكهربائية الصادرة من المحركات بتحويل بعض الأكسجين إلى أوزون. وبالإمكان إنتاج الأوزون صناعيًا عن طريق التفريغات الكهربائية في آلة تسمى مولد الأوزون.
يوجد معظم الأوزون في الطبقات العليا من الجو، وتوجد أعلى نسبة تركيز على ارتفاع يتراوح مابين 15 و30 كم عن سطح الأرض ويعتمد ذلك على خط العرض. ويمثل هذا التركيز عشرة أجزاء في المليون بالحجم - أي عشرة أجزاء أوزون لكل مليون جزء من الهواء. تعمل طبقة الأوزون في الطبقة العليا من الجو كحجاب واقٍ للأرض من 95% إلى 99% من أشعة الشمس فوق البنفسجية التي تعتبر سببًا يؤدي لسرطان الجلد، إذا ماتعرض لها الإنسان بكثرة.
أعرب بعض العلماء في أواسط السبعينيات من القرن العشرين عن قلقهم من أن المركبات الكيميائية المسماة الكلوروفلوروكربون (ك ف ك) هي المسؤولة عن خرق طبقة الأوزون الواقية للأرض.
وكانت مركبات (ك ف ك) تستعمل بكثرة في ذلك الوقت كمادة دافعة في علب رش الهباء الجوي. عندما ينبعث هذا المركب من العلبة يصعد ببطء في الهواء وعندما يصل إلى طبقات الجو العليا تقوم أشعة الشمس فوق البنفسجية بتفتيت هذا المركب إلى أجزاء يتفاعل بعضها مع الأوزون الموجود في تلك الطبقة، وبذلك يقلل من كمية الأوزون.
ولكن العلماء سرعان ما اكتشفوا أن انخفاض نسبة الأوزون الموجود في طبقات الجو العليا يعتمد على خط العرض، إذ يكون الانخفاض أشد في المناطق الواقعة على القطب الجنوبي (أنتارتيكا)، حيث يكوّن ¸ثقبًا·. وأصدر علماء من المركز البريطاني لدراسة القطب الجنوبي في عام 1985م، أول تقرير عن وجود ثقب في طبقة الأوزون فوق خليج هالي. وفي عام 1986م قامت كل من الهيئة الوطنية لإدارة أبحاث الملاحة الجوية والفضاء الأمريكية (NASA)، والمنظمة العالمية للأرصاد الجوية، وبرنامج الأمم المتحدة للبيئة (UNEP)، بتأسيس هيئة معدل الأوزون لدراسة نفاد كمية الأوزون في الجو.
وقد جمع بعض أعضاء هذه الهيئة معلومات من خلال الأقمار الصناعية ومن معدات على الأرض، ونشروا استنتاجاتهم في مارس من عام 1988م. وقد أكدت انخفاض نسبة الأوزون فوق منطقة القطب الجنوبي. واستنتج أعضاء هذه الهيئة أيضًا أنّ نسبة الأوزون في مناطق القطب الشمالي منخفضة، ولكن ليست إلى تلك الدرجة التي تؤدي إلى تكوين ثقب كما هو الحال في منطقة القطب الجنوبي.
وفي أوروبا وضعت كل من ألمانيا وفرنسا خططًا للبحث تسمى مشروع كيمياء الأوزون في الغلاف الزمهريري القطبي، وكان غرض هذا المشروع هو دراسة نضوب كمية الأوزون في المناطق الشمالية.
وفي عام 1987م وقعت إحدى وثلاثون دولة اتفاقية مونتريال التي تقضي بالحد من إنتاج مركبات (ك ف ك). وقد تم تنفيذ هذه الاتفاقية في الأول من يناير عام 1989م. وفي إعادة لتقييم اتفاقية مونتريال في عام 1990، اتضح أن إنتاج مركبات (ك ف ك) انخفض في جميع أنحاء العالم، ولكنه اتضح أيضًا أن المركبات التي أنتجت كبديل لمركبات (ك ف ك) ضارة أيضًا بطبقة الأوزون.
ودعت اتفاقية مونتريال المجددة في عام 1990م بالإيقاف الكلي لإنتاج مركبات (ك ف ك) في نهاية القرن الحالي.
ولكن الجو سيبقى ملوثًا بمركبات (ك ف ك) لعدة سنوات حتى بعد إيقاف إنتاج هذه المركبات؛ وذلك لأن كمية كبيرة منها تتسرَّب إلى الجو من المكيفات الهوائية والثلاجات. كما أن العلماء يتوقعون أن يزداد تآكل طبقة الأوزون أكثر في السنوات القادمة، لأن مركبات (ك ف ك) تعمر طويلاً. وهذا سيؤدِّي إلى زيادة كمية الأشعة فوق البنفسجية التي تصل إلى الأرض، وبخاصة في مناطق جنوب أستراليا ونيوزيلندا.
يعتبر معظم الأوزون الموجود في طبقات الجو السفلى مسببًا لتلوث الهواء، إذ إنه يتكون نتيجة للتفاعلات الكيميائية بين أشعة الشمس والمواد المسببة للتلوث الموجودة في الجو. والأوزون الناتج عن هذا التفاعل عبارة عن مركب دخاني ضوئي كيميائي. انظر: الضباب الدخاني. ويستطيع هذا النوع من الأوزون أن يتلف مباشرة مواد المطاط والبلاستيك والنبات وأنسجة الحيوانات. وقد يتعرَّض هذا الأوزون إلى المزيد من التفاعلات الكيميائية التي تولد مواد كيميائية أخرى ضارة. والتعرّض إلى نسب معينة من هذا الأوزون يسبب صداعًا وحرقة في العينين، وتهيجًا في مجرى التنفس عند العديد من الأفراد.
والصيغة الكيميائية للأوزون هي O3 ويبلغ وزنه الجزيئي 47,998. أما الأوزون الخام فهو غاز أزرق باهت.
عُرف الأوزون لأول مرة عن طريق رائحته الحادة المزعجة التي غالبًا ما تلاحظ قرب المفاتيح الكهربائية والآلات.
استخداماته
يُكشف عن الأوزون في مزيج غازي بالتفاعل الآتي:
يتكوَّن الأوزون في العمليات التي يرافقها انطلاق الأوكسجين الذري، وفي الصناعة يُحصَل عليه من الهواء ومن الأوكسجين بالانفراغ الكهربائي في درجات منخفضة من الحرارة.[79]
تتيح خاصيات الأوزون الشديدة الأكسدة استعماله في تحضير كثير من المركبات العضوية وفي تبييض الورق والزبدة.
يقتل الأوزون الأحياء الدقيقة، لذلك يستعمل في تنقية مياه الشرب والهواء. وهو سام جداً (تزيد سميته على سمية CO)، ويساوي التركيز الحدّي المسموح به للأوزون في الهواء 10-5 %.
الخصائص الفيزيائية
التركيب
هو غاز أزرق اللون شديد الانفجار ذو رائحة واخزة مميزة، كثافته بالنسبة للهواء 62.1، ودرجة غليانه -122ْس، يكوِّن في الدرجات التي هي أخفض من درجة غليانه سائلاً أزرق داكناً تبلغ كثافته 71.1 غ/سم3 . وفي الدرجة -183ْس يكون الأوزون ذا مغنطيسية عكسية في الحالة الغازية وذا مغنطيسية طردية ضعيفة في الحالة السائلة. ينحل الأوزون في الماء بنسبة 0.394غ/سم3 في الدرجة 0ْس، أي أكثر بخمس عشرة مرة من انحلال الأكسجين.
الكيمياء
يتكون الأوزون بالتفاعل العكوس:
ويتفكك جزيء الأوزون تلقائياً إلى الأكسجين ناشراً الحرارة، ويتفكك في التركيزات العالية منفجراً. أما في التركيزات البسيطة العادية، وفي حال عدم وجود شوائب غريبة، فيتفكك ببطء. ويتسارع تفكك الأوزون بشدة بتسخينه أو بملامسته لشيء من المركبات العضوية أو لبعض المعادن أو أكاسيدها. وتؤثر المقادير البسيطة من حمض الآزوت HNO3 في استقرار الأوزون.
وهو لا يتفكك إذا كان محفوظاً في الدرجة -78ْس في أوعية زجاجية أو لدائنية أو أوعية مصنوعة من معادن صرفة.
والأوزون هو أحد المؤكسِدات القوية (أقوى من الأكسجين العادي)، يؤكسد جميع المعادن (ما عدا الذهب والبلاتين وما يماثلهما) ومعظم العناصر الأخرى. ويعطي أوزونيدات مع بعض المركبات العضوية واللاعضوية.
تأثير الأوزون على الحياة
وجود الأوزون في الغلاف الجوى يعمل كرداء كونى يقوم بعملية تنظيف أوتعقيم البيئة بالإضافة إلى حماية الإرض من الأشعة فوق البنفسجية التى تصلنا من الشمس والتى يتولى الأوزون إمتصاص أكثرمن 99% منها وبذلك يحمى أشكال الحياة المعروفه على سطح الأرض .
يشعر بعض الناس بتأثير الأوزون عندما يوجد في الهواء بتركيز 0.001 جزء من المليون. وعندما يصبح بتركيز يراوح بين 0.5 و0.1 جزء من المليون يضطرب لديهم تنسيق تقلصات عضلات العين، وتنخفض حدة الرؤية. وتظهر وذمة رئوية عند الذين يتم تعريضهم تجريبياً لتركيز أقل من جزء واحد من المليون.
وتذكر وكالة حماية البيئة الأمريكية أن تركيز 0.15 جزءاً من المليون يسبب ضيقاً في الصدر وتخريشاً للجهاز التنفسي وانخفاضاً في وظيفة التنفس. ويسبب 0.17 جزءاً من المليون تفاقم حالات الربو والتهاب القصبات الحاد، وفي تركيز 0.18 جزءاً من المليون تنخفض مقاومة الأفراد للإصابة الجرثومية. أما تركيز 0.12 جزءاً من المليون فيعد الحد الأعلى للسلامة المسموح بها.
أما في الصناعة فيُسمح بالتعرض مدة 8 ساعات من العمل لتركيز مقداره 0.5 جزءاً من المليون، علماً أن تركيزات الأوزون في بعض الصناعات قد تصل أحياناً إلى جزء واحد من المليون، ويمكن أن يحصل هذا التركيز في حالات تلوث الهواء تلوثاً شديداً في بعض الأماكن، مثل مدينة لوس أنجلس في الولايات المتحدة الأمريكية, ويزداد تركيز الأوزون في الارتفاعات العالية، كما يحصل في الطائرات التي تحلق على ارتفاع يزيد على 9 كيلو مترات. وعلى ارتفاع 25- 30كم يصل التركيز إلى 12 جزءاً من المليون، وهو الحد الذي يموت عنده الإنسان.
ولما كان الأوزون مادة مؤكسدة شديدة الفعالية، كان تركيزه يسبب تلف المحاصيل الزراعية والنباتات، ويسبب التخرب المبكر للمطاط والأنسجة، فتظهر على الأوراق قشور رقيقة حمراء، ويسبب ابيضاض النباتات ويثبط نموها ويؤدي إلى شيخوختها المبكرة.
ولما كان الأوزون يسبب تناثر المعلقات الخفيفة فقد أسهم، مع المواد المؤكسدة الأخرى، في خفض الرؤية.
التحضير
يحضر الأوزون عادة في الظروف الكيميائية المناسبة 2التي لا يتفاعل فيها الأكسجين.[29] الأوزون المستخدم صناعيا يقاس بالجرام/نانومتر المكعب. ويحضر بإدماج من 1-5 وزن مئوي في الهواء إلى من 6-14 من الأكسجين.
العلاج بالأوزون
انظر
 مقالة مفصلة: العلاج بالأوزون
مقالة مفصلة: العلاج بالأوزون
القياسات التي أجريت على الأوزون
أجري منذ أواخر السبعينات من القرن العشرين نوعان من القياسات الخاصة بطبقة الأوزون. ففي القياس الأول تؤكد قياسات الأقمار الصناعية، على ما يبدو، النظرية القائلة إن طبقة الأوزون تتعرض لاستنزاف تدريجي. وتشير هذه القياسات إلى أن تركيز الأوزون قد انخفض عدة أجزاء في المئة منذ عام 1979، ووصلت نسبة الانخفاض إلى 18 في المئة في المناطق المتوسطة من نصف الكرة الجنوبي.
وفي القياس الثاني الذي تم في شهري أيلول وتشرين الأول من سنوات هذه المدة كلها تقريباً، بَيَّنت القياسات فوق القطب الجنوبي أن استنزاف الأوزون كان أكثر إثارة، وهو ما أصبح يعرف باسم ثقب الأوزون. ومع أن الثقب يمتلئ في الصيف فهو يعود كل سنة أكثر عمقاً من السابق. وقد كان متوسط تركيز الأوزون فوق القطب الجنوبي في تشرين الأول من عام 1985 أقل بنحو 40 في المئة مما كان عليه في تشرين الأول من عام 1979. وليس هناك إجماع على سبب هذه الظاهرة القطبية الجنوبية، كما أنه لا يوجد اتفاق على العلاقة بين ثقب القطب الجنوبي والاستنزاف العالمي للأوزون.
نضوب الأوزون والثقب الأوزوني وأسباب هذا النضوب
إن العوامل المؤثرة في مصير الغازات وتأثيراتها المتبادلة بينها وبين الكرة الحية biosphere معقدة وغير مفهومة جيداً. فالتفاعلات الكيمياوية التي يقوم بها مثلاً غاز ما في الكرة الحية تتوقف على مزيج الغازات والجسيمات القريبة منه، وعلى درجة الحرارة وشدة الشمس واختلاف أنواع الغيوم، وأنماط جريان الهواء التي تحرك الكيمياويات أفقياً وعمودياً. وتؤثر التفاعلات كذلك في طول المدة الزمنية التي يبقى فيها الغاز في الجو، وفيما إذا كان للغاز نفسه أو النواتج النهائية من تفاعله تأثير شامل (عالمي)، أو أن تأثيراتها البيئية لا تتجاوز حدود المنطقة التي توجد فيها.
ويعد بعض الباحثين الثقب الأوزوني إنذاراً بكارثة عالمية وشيكة الوقوع. ويعزى نضوب الأوزون الستراتوسفيري أساساً إلى مركبات الكلوروفلوروكربون Chlorofluorocarbon الصناعية، وهي مركبات تحوي الكلور والفلور والكربون، وتحوي الهيدروجين أحياناً، ولاسيما المركب (CF2Cl2) CF - 12(CFCl3)CFC -11. وقد ازدادت انبعاثات هذه الكيمياويات المتولدة عن النشاط البشري وتركيزاتها بسرعة منذ عدة عقود، أي في الوقت الذي راج فيه استعمالها مبرّداتٍ أو حُلاَلاَتٍ هوائية (دواسر الحُلاَلاَت أو الرذيذات) aerosol propellants ومذيباتٍ وعواملَ نفخٍ لتكوين الرغوة. ومما عزَّز من رواج هذه الكيمياويات تمتعها بخاصة بدت جيدة في باديء الأمر وهي خمولها في الطبقة المنخفضة من الجو، فهي لذلك ليس لها فعل سُمِّيٌ مباشر في الكائنات الحية. ولا تتجاوز نسبة هذه المركبات مجتمعة في الجو جزءاً واحداً في البليون تقريباً. وتتحلل هذه المركبات بوساطة الأشعة فوق البنفسجية في الستراتوسفير فيتحرر الكلور الذي يحفز عملية تحليل الأوزون إلى أكسجين جزيئي O2:
ثم يتفاعل أحادي أكسيد الكلور مع ذرات من الأكسجين (تتكوّن نتيجة التفكك الضوئي لجزيء آخر من الأوزون)، وينطلق الكلور الذي يعيد الدورة من جديد.
أما البروم Br2 فيتكوَّن في الستراتوسفير من مصدرين رئيسيين ينجمان عن فعاليات الإنسان وهما بروميد الميثيل والهالونات. والهالون هو الاسم التجاري لمتبلمر تترافلورو الأثيلين. ولبروميد الميثيل مصدران: مصدر طبيعي ومصدر بشري، أما الهالونات فلها مصدر بشري فقط. ويبلغ إجمالي الوفرة الجوية للبروم نحو 15-20 جزءاً لكل ترليون جزء حجماً. والهالونات، بصفتها مواد كيمياوية «مهلجنة» (تحوي في تركيبها هالوجيناً. والهالوجينات هي الفلور والكلور والبروم واليود) ذات عمر طويل نسبياً (مستقرة)، فإنها تتفكك بتأثير الضوء في طبقة الستراتوسفير من الغلاف الجوي، فينبعث منها بروم ذو قدرة تحفيزية عالية في تدمير طبقة الأوزون. فالبروم عامل مدمر للأوزون، وقدرته على استنزافه أكبر من قدرة الكلور بنحو 10- 100 مرة.
والتفاعلات المتعلقة بالبروم هي المسؤولة عن التدمير الكيمياوي لطبقة الأوزون بنسبة 25% فوق القطب الجنوبي للأرض، وبنسبة 50% فوق القطب الشمالي.
وسلسلة التفاعلات التحفيزية للبروم هي كالآتي:
وتُرجِع نظرية أخرى السبب في ثقب الأوزون بالقطب الجنوبي واستنزاف الأوزون العالمي إلى أكاسيد الآزوت (النتروجين). فدورة الكلور التحفيزية لا تتم عادة من دون قيود ومداخلات. فهناك نوعان رئيسيان من التفاعلات يُعتَقَد أنهما يتدخلان في عملية تحطيم الأوزون، على الأقل عند الارتفاعات المتوسطة. ففي إحدى الحالات يتفاعل أكسيد الكلور ClO مع أكسيد الآزوت NO، وتنتقل ذرة الأكسجين في أكسيد الكلور إلى أكسيد الآزوت NO منتجة ذرة كلور حرة وثنائي أكسيد الآزوت NO2. وعندما يمتص ثنائي أكسيد الآزوت الضوء المرئي، فإنه يحرر ذرة أكسجين تكون جاهزة لكي تعيد توليد الأوزون:
وتكون النتيجة عدم حدوث تغير في مستوى الأوزون.
وفي حالة ثانية أكثر أهمية يؤدي اتحاد ذرة الكلور أو جذر أحادي أكسيد الكلور بجزيء آخر إلى ناتج مستقر يقوم مؤقتاً بدور «مستودع» للكلور. وعند ارتباط الكلور على هذا النحو (كما هي الحال في معظم الوقت بالجو العادي)، فإنه لا يتيسر له مهاجمة الأوزون. وهناك مستودعان مهمان هما نترات الكلور ClONO2 المكونة من اتحاد أحادي أكسيد الكلور بثنائي أكسيد الآزوت NO2، وحمض كلور الماء HCl الذي يتكون من تفاعل ذرة الكلور مع الميثان CH4. وفي نهاية المطاف فإن هذين المستودعين يمتصان فوتوناً أو يتفاعلان مع مواد كيمياوية أخرى، ويتفككان فيتحرر الكلور ليستأنف تحفيزه في تحطيم الأوزون.
تعزِّز درجات الحرارة المنخفضة، خاصة في القارة القطبية الجنوبية، وبدرجة أقل في القطب الشمالي، دورات الكلور التحفيزية، وذلك بإزالة أكاسيد الآزوت التي تعيق هذه الدورات (مع أن غازات NOx يمكنها أن تخرب الأوزون، إذ يعزز وجودها في الستراتوسفير غالباً عملية تخريب الأوزون المحفِّزَة بالكلور. والتناقض هنا ظاهري). إذ تتجمد غازات NOx مع الماء مشكلة جسيمات تعرف باسم الغيوم الستراتوسفيرية القطبية. وتسهّل الجسيمات الغيمية عملياً حدوث التفاعلات السابقة الذكر التي تؤدي إلى انطلاق الكلور من مركبات لا تتفاعل هي نفسها مع الأوزون مثل HCl و ClNO3.
إن تركيزات أكاسيد الآزوت في الجزء السفلي من الستراتوسفير ترتفع وتنخفض مع دورة الإحدى عشرة سنة للنشاط الشمسي. وقُبيل الذروة الشمسية (تصبح حرارة الشمس في ذروتها عندما يكون الكلف الشمسي Sunspot في مستواه الأدنى، وهذا يحدث دورياً كل 11 سنة) تنتقل كميات كبيرة من مركبات الآزوت التي تتولد في الجزء العلوي من الستراتوسفير إلى الجزء السفلي منه بفعل دوامة القطب الجنوبي، وهي نوع من الريح الدائرية التي تستقر فوق القطب الجنوبي في الشتاء القطبي الطويل. وتتسبب شمس الربيع في التحليل الضوئي لبعض المركبات لتنتج أول أكسيد الآزوت NO وثنائي أكسيد الآزوت NO2 المبددين للأوزون، وتنتشر أكاسيد الآزوت في الستراتوسفير، مبددة الأوزون فوق أجزاء أخرى من الكرة الأرضية. ومع أن هذه النظرية لا تبرئ مركبات كلوروفلورو الكربون بحال من الأحوال، فإنها ترى أن معظم استنزاف الأوزون الذي رُوقب حتى اليوم، يحدث دورياً لأسباب طبيعية.
وما يزال باحثون آخرون يعتقدون أن الثقب القطبي الجنوبي من جهة، والنقص في ثخانة طبقة الأوزون العالمية من جهة أخرى، هما ظاهرتان منفصلتان تماماً، وأن الثقب لم يتكون بفعل المواد الكيمياوية بل بفعل الرياح. إذ لوحظ أن الكمية الكلّية للأوزون الجوي في اتجاه القطب وفي مدى 44 درجة جنوب خط الاستواء تكاد تبقى ثابتة عندما يتكون الثقب القطبي كل ربيع. والتفسير المحتمل لهذا هو أن تيارات الهواء الصاعدة تدفع الهواء الغني بالأوزون الموجود في الجزء السفلي من الستراتوسفير بعيداً عن القطب، ويحل محله هواء من خطوط العرض الدنيا يفتقر إلى الأوزون. ويجتمع الهواء الغني بالأوزون على هيئة حلقة عند خطوط العرض دون القطبية حيث يقاس حقاً نسبة عالية من تركيز الأوزون. وهكذا فإن الثقب يتعمق من سنة إلى أخرى لأن الاندفاع نحو الأعلى يزداد لأسباب غير واضحة حتى اليوم.
وقد حصل باحثون آخرون ضمن بعثة توجهت حديثاً إلى القطب الجنوبي على دليل أولي يناقض نظريتي الدورة الشمسية ونظرية الريح كلتيهما. وما يزال الجدل قائماً بين أنصار كل من هذه النظريات، وقد يحتاج الأمر إلى عدة سنوات قبل الوصول إلى تفسير واحد لظاهرة الثقب الأوزوني ولظاهرة استنزاف الأوزون.
انغلاق أكبر ثقب بالأوزون على الإطلاق فوق القطب الشمالي
أعلنت خدمة كوبرنيكوس لرصد الغلاف الجوى أن أكبر ثقب لوحظ فى طبقة الأوزون فوق القطب الشمالى قد أغلق، إذ اكتشف العلماء علامات تشكله في أواخر مارس، ويعتقد أنه كان نتيجة درجات الحرارة المنخفضة في القطب الشمالي.
وتحمى طبقة الأوزون الأرض من معظم أشعة الشمس فوق البنفسجية، التى تعد سببا رئيسيا لسرطان الجلد، وكان من الممكن أن يشكل هذا الثقب تهديدًا مباشرًا للبشر لو انتقل جنوبًا إلى مناطق مأهولة بالسكان، لكن يوم الخميس (23 أبريل)، أعلنت كوبرنيكوس - برنامج الاتحاد الأوروبى لمراقبة الأرض - أن الثقب قد تم إغلاقه الآن.
ولا علاقة للإغلاق بالحد من التلوث الناجم عن عمليات الإغلاق بجزء كبير من العالم بسبب COVID-19.، بدلاً من ذلك، يعود الأمر إلى الدوامة القطبية، والتيارات العالية الارتفاع التى تجلب عادةً الهواء البارد إلى المناطق القطبية، مما أعطى منطقة القطب الشمالى موجة حرارية نسبية، مع درجات حرارة تصل إلى 20 درجة مئوية أعلى من المعتاد فى هذا الوقت من العام.
وقال عالم كوبرنيكوس Antje Inness "من غير المعتاد أن يحدث مثل هذا الاستنفاد القوى للأوزون فى نصف الكرة الشمالى، لكن الدوامة القطبية لهذا العام كانت قوية ومستمرة بشكل استثنائى، وكانت درجات الحرارة منخفضة بما يكفى للسماح بتكوين السحب الستراتوسفيرية لعدة أشهر.
ويوجد ثقب الأوزون الأكثر شهرة فوق القطب الجنوبى ويحدث خلال الربيع الأسترالى (من يوليو إلى سبتمبر) عندما يكون الستراتوسفير أكثر برودة بشكل طبيعي، بشكل عام ، لا تحدث ظروف تدمير الأوزون على هذا النطاق فى القطب الشمالى، لكن هذا العام، تسببت الدوامة القطبية القوية والمستقرة فى تركيز المزيد من المواد الكيميائية المستنفدة للأوزون أكثر من المعتاد، والتى أضافت إلى البرد القارس خلقت الظروف لهذا الثقب غير المسبوق.
وكانت المرة الأولى التى لوحظ فيها ثقب للأوزون فى القطب الشمالى فى عام 2011، لكنه كان أصغر وكان خلال شهر يناير.[80]
انظر أيضا
- Chappuis absorption
- Cyclic ozone
- Global Ozone Monitoring by Occultation of Stars (GOMOS)
- International Day for the Preservation of the Ozone Layer (September 16)
- Lightning
- Nitrogen oxides
- Ozone depletion, including the phenomenon known as the ozone hole.
- Ozone monitor
- Ozone monitoring instrument
- Ozone therapy
- Ozoneweb
- Ozonide (ion)
- Ozonolysis
- Polymer degradation
- Sterilization (microbiology)
- شبكة الأوزون
- ثقب الأوزون
المراجع
ملاحظات
- ^ This vapor pressure is for the critical temperature, which is below room temperature.
- ^ This includes Adams, Arapahoe, Boulder, Broomfield, Denver, Douglas, Jefferson, and parts of Larimer and Weld counties.
الهامش
- ^ أ ب ت ث ج NIOSH Pocket Guide to Chemical Hazards 0476
- ^ Gas Encyclopedia; Ozone
- ^ Cuthbertson, Clive; Cuthbertson, Maude (1914). "On the Refraction and Dispersion of the Halogens, Halogen Acids, Ozone, Steam Oxides of Nitrogen, and Ammonia". Philosophical Transactions of the Royal Society A. 213 (497–508): 1–26. Bibcode:1914RSPTA.213....1C. doi:10.1098/rsta.1914.0001. Retrieved 4 February 2016.
- ^ "Ozone". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Streng, A. G. (1961). "Tables of Ozone Properties". Journal of Chemical & Engineering Data. 6 (3): 431–436. doi:10.1021/je00103a031.
- ^ Batakliev, Todor; Georgiev, Vladimir; Anachkov, Metody; Rakovsky, Slavcho; Zaikov, Gennadi E. (June 2014). "Ozone decomposition". Interdisciplinary Toxicology. 7 (2): 47–59. doi:10.2478/intox-2014-0008. ISSN 1337-6853. PMC 4427716. PMID 26109880.
- ^ "ozone (n.)". Online Etymological Dictionary. Merriam-Webster. Retrieved 24 May 2023.
- ^ أ ب Toth, Gary; Hillger, Don. "Precursor Era Contributors to Meteorology". colostate.edu.
- ^ "electrochemical reaction | Definition, Process, Types, Examples, & Facts | Britannica". britannica.com (in الإنجليزية). Retrieved 2022-09-24.
- ^ أ ب ت ث Rubin, Mordecai B. (2001). "The History of Ozone: The Schönbein Period, 1839–1868" (PDF). Bull. Hist. Chem. 26 (1): 40–56. doi:10.70359/bhc2001v026p040. Archived (PDF) from the original on 2008-04-11. Retrieved 2025-01-29.
{{cite journal}}: Check|doi=value (help) - ^ "Scientists born on October 18th". Today in Science History.
- ^ أ ب ت ث Jacewicz, Natalie (2017). "A Killer of a Cure". Distillations. 3 (1): 34–37. Retrieved April 13, 2018.
- ^ Le Prestre, Philippe G., ed. (1998). Protecting the ozone layer: lessons, models, and prospects; [product of the Tenth Anniversary Colloquium of the Montreal Protocol, held on September 13, 1997; part of a series of events held in Montreal to mark the 10th anniversary of the signing of the Montreal Protocol on Substances that Deplete the Ozone Layer, September 16, 1987]. Boston: Kluwer. p. 2. ISBN 978-0-7923-8245-4.
- ^ Schönbein, Christian Friedrich (1840). "Research on the nature of the odour in certain chemical reactions". Letter to the Académie des Sciences in Paris.
- ^ Jacques-Louis Soret (1865). "Recherches sur la densité de l'ozone". Comptes rendus de l'Académie des sciences. 61: 941.
- ^ "Ozone FAQ". Global Change Master Directory. Archived from the original on 2006-06-01. Retrieved 2006-05-10.
- ^ Redlands Chamber of Commerce Collection, City Archives, A.K. Smiley Public Library, Redlands, CA
- ^ "Ozone". Hall's Journal of Health. 26 (3): 772. March 1879. PMC 9211524. PMID 36488870.
- ^ Henry Henshaw to William Brewster, July 2, 1902, Harvard Museum of Comparative Zoology Archives.
- ^ O'Connell, Sanjida (18 August 2009). "The science behind that fresh seaside smell". The Telegraph. Archived from the original on 2022-01-12.
- ^ "Secrets of 'bracing' sea air bottled by scientists". telegraph.co.uk. 2 February 2007. Retrieved 2022-05-13.
- ^ Anstie, Francis (1874). "Clinic of the Month: Dr. McKendrick on Ozone". The Practitioner: A Journal of Therapeutics and Public Health. 12 (January–June): 123.
- ^ Rubin, Mordecai B. (2001). "The History of Ozone: The Schönbein Period, 1839–1868" (PDF). Bulletin for the History of Chemistry. 26 (1): 48. doi:10.70359/bhc2001v026p040. Retrieved 13 April 2018.
{{cite journal}}: Check|doi=value (help) - ^ Hill, L.; Flack, M. (28 December 1911). "The Physiological Influence of Ozone". Proceedings of the Royal Society B: Biological Sciences. 84 (573): 404–415. Bibcode:1911RSPSB..84..404H. doi:10.1098/rspb.1911.0086.
- ^ Stoker, George (1916). "The Surgical Uses of Ozone". Lancet. 188 (4860): 712. doi:10.1016/S0140-6736(01)31717-8.
- ^ أ ب ت Rubin, Mordecai B. (2004). "The History of Ozone. IV. The Isolation of Pure Ozone and Determination of its Physical Properties (1)" (PDF). Bull. Hist. Chem. 29 (2): 99–106. doi:10.70359/bhc2004v029p099. Retrieved 2021-04-12.
{{cite journal}}: Check|doi=value (help) - ^ أ ب Block, J. H. (1986), Vanselow, R.; Howe, R., eds. (in en), Georg-Maria Schwab: Early Endeavours in the Science of Catalysis, Springer Series in Surface Sciences, 5, Berlin, Heidelberg: Springer, pp. 1–8, doi:, ISBN 978-3-642-82727-3
- ^ "Oxygen". WebElements. Retrieved 2006-09-23.
- ^ أ ب Brown, Theodore L.; LeMay, H. Eugene Jr.; Bursten, Bruce E.; Burdge, Julia R. (2003) [1977]. "22". In Nicole Folchetti (ed.). Chemistry: The Central Science (9th ed.). Pearson Education. pp. 882–883. ISBN 978-0-13-066997-1.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey (1988). Advanced Inorganic Chemistry (5th ed.). John Wiley & Sons. p. 452. ISBN 0-471-84997-9.
Ozone. The diamagnetic triatomic molecule ...
- ^ "Microwave Rotational Spectroscopy". Chemistry LibreTexts (in الإنجليزية). 2013-10-02. Retrieved 2022-07-13.
- ^ Tanaka, Takehiko; Morino, Yonezo (1970). "Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states". Journal of Molecular Spectroscopy. 33 (3): 538–551. Bibcode:1970JMoSp..33..538T. doi:10.1016/0022-2852(70)90148-7.
- ^ Mack, Kenneth M.; Muenter, J. S. (1977). "Stark and Zeeman properties of ozone from molecular beam spectroscopy". Journal of Chemical Physics. 66 (12): 5278–5283. Bibcode:1977JChPh..66.5278M. doi:10.1063/1.433909.
- ^ Half-life time of ozone as a function of air conditions and movement McClurkin, J.D.*#1, Maier, D.E.2. DOI:10.5073/jka.2010.425.167.326
- ^ Koike, K; Nifuku, M; Izumi, K; Nakamura, S; Fujiwara, S; Horiguchi, S (2005). "Explosion properties of highly concentrated ozone gas" (PDF). Journal of Loss Prevention in the Process Industries. 18 (4–6): 465. Bibcode:2005JLPPI..18..465K. doi:10.1016/j.jlp.2005.07.020. Archived from the original (PDF) on 2009-03-27.
- ^ "Electrochemical Production of High-Concentration Ozone-Water Using Freestanding Perforated Diamond Electrodes".
- ^ Harris, Daniel C. (2007). Quantitative Chemical Analysis. W. H. Freeman. pp. 279. ISBN 978-0-7167-7694-9.
- ^ Bailey, P. S. (1982). "Chapter 2". Ozonation in Organic Chemistry. Vol. 2. New York, NY: Academic Press. ISBN 978-0-12-073102-2.
- ^ Solomons, T.W. Graham & Fryhle, Craig B. (2008). "Chapter 8 Alkenes and Alkynes – Part II: Addition Reactions and Synthesis". Organic Chemistry, 9th Edition. Wiley. p. 344. ISBN 978-0-470-16982-7.
- ^ Al-Baarri, A. N.; Legowo, A. M.; Abduh, S. B. M.; Mawarid, A. A.; Farizha, K. M.; Silvia, M. (June 2019). "Production of Ozone and the Simple Detection using Potassium Iodide Titration Method". IOP Conference Series: Earth and Environmental Science (in الإنجليزية). 292 (1) 012062. Bibcode:2019E&ES..292a2062A. doi:10.1088/1755-1315/292/1/012062. ISSN 1755-1315. S2CID 198344024.
- ^ أ ب Horvath M.; Bilitzky L.; Huttner J. (1985). Ozone. Elsevier. pp. 44–49. ISBN 978-0-444-99625-1.
- ^ Menzel, D. B. (1984). "Ozone: an overview of its toxicity in man and animals". Journal of Toxicology and Environmental Health. 13 (2–3): 183–204. Bibcode:1984JTEH...13..181M. doi:10.1080/15287398409530493. ISSN 0098-4108. PMID 6376815.
- ^ "Ozone Generators that are Sold as Air Cleaners". EPA. United States Environmental Protection Agency. 28 February 2022. Archived from the original on 9 February 2022. Retrieved 28 February 2022.
- ^ Roca Sánchez, Anna (2015-09-01). Estudio cinético de la descomposición catalítica de ozono (Thesis).
- ^ Flowers, Paul; Theopold, Klaus; Langley, Richard; William R. Robinson, PhD (2019-02-14). "12.6 Reaction Mechanisms - Chemistry 2e | OpenStax". openstax.org (in English). Retrieved 2025-05-02.
{{cite web}}: CS1 maint: unrecognized language (link) - ^ Batakliev, Todor; Georgiev, Vladimir; Anachkov, Metody; Rakovsky, Slavcho; Zaikov, Gennadi E. (June 2014). "Ozone decomposition". Interdisciplinary Toxicology. 7 (2): 47–59. doi:10.2478/intox-2014-0008. ISSN 1337-6853. PMC 4427716. PMID 26109880.
- ^ قالب:Housecroft2nd
- ^ قالب:Housecroft2nd
- ^ Horvath M.; Bilitzky L.; Huttner J. (1985). Ozone. Elsevier. pp. 259, 269–270. ISBN 978-0-444-99625-1.
- ^ Shimanouchi, T. (1972). "Ozone". NIST: National Institute of Standards and Technology. U.S. Department of Commerce. 6 (3): 993–1102.
- ^ World Meteorological Organization. "Chapter 16: Measurement of Ozone" (PDF). Part I: Measurement of Meteorological Variables. Archived from the original (PDF) on 31 March 2016.
- ^ Max Planck Institute – Mainz. "The MPI-Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest".
- ^ "Measured Ozone Depletion". Ozone-Information.com. Archived from the original on 2013-09-14. Retrieved 2014-01-22.
- ^ Hultman, G. Eric (1980-01-01). The Ozone Survival Manual. McGraw-Hill. ISBN 978-0-915498-73-4.
- ^ Keller-Rudek, Hannelore. "The MPI-Mainz UV/VIS Spectral Atlas of Gaseous Molecules of Atmospheric Interest: O2, Lyman-alpha". Archived from the original on 2015-11-17.
- ^ Matsumi, Yutaka; Kawasaki, Masahiro (2003). "Photolysis of Atmospheric Ozone in the Ultraviolet Region". Chemical Reviews. 103 (12): 4767–82. Bibcode:2003ChRv..103.4767M. doi:10.1021/cr0205255. PMID 14664632. See the graphical absorption of ozone in two of its absorption bands, as a function of wavelength.
- ^ Health Aspects of Air Pollution with Particulate Matter, Ozone and Nitrogen Dioxide Archived 2012-04-14 at the Wayback Machine. WHO-Europe report 13–15 January 2003 (PDF)
- ^ Stevenson; et al. (2006). "Multimodel ensemble simulations of present-day and near-future tropospheric ozone". Journal of Geophysical Research: Atmospheres. American Geophysical Union. 111 (D8) 2005JD006338. Bibcode:2006JGRD..111.8301S. doi:10.1029/2005JD006338. Archived from the original on 2011-11-04. Retrieved 2006-09-16.
- ^ "Rising Ozone Levels Pose Challenge to U.S. Soybean Production, Scientists Say". NASA Earth Observatory. 2003-07-31. Archived from the original on 2010-03-16. Retrieved 2006-05-10.
- ^ أ ب Mutters, Randall (March 1999). "Statewide Potential Crop Yield Losses From Ozone Exposure". California Air Resources Board. Archived from the original on 2004-02-17. Retrieved 2006-05-10.
- ^ Rethinking the Ozone Problem in Urban and Regional Air Pollution. 1991-01-01. doi:10.17226/1889. ISBN 978-0-309-04631-2.
- ^ أ ب Sharma, Sumit; Sharma, Prateek; Khare, Mukesh; Kwatra, Swati (May 2016). "Statistical behavior of ozone in urban environment". Sustainable Environment Research. 26 (3): 142–148. Bibcode:2016SusER..26..142S. doi:10.1016/j.serj.2016.04.006.
- ^ Diem, Jeremy E.; Stauber, Christine E.; Rothenberg, Richard (2017-05-16). Añel, Juan A. (ed.). "Heat in the southeastern United States: Characteristics, trends, and potential health impact". PLOS ONE. 12 (5) e0177937. Bibcode:2017PLoSO..1277937D. doi:10.1371/journal.pone.0177937. ISSN 1932-6203. PMC 5433771. PMID 28520817.
- ^ Hou, Pei; Wu, Shiliang (July 2016). "Long-term Changes in Extreme Air Pollution Meteorology and the Implications for Air Quality". Scientific Reports. 6 (1) 23792. Bibcode:2016NatSR...623792H. doi:10.1038/srep23792. ISSN 2045-2322. PMC 4815017. PMID 27029386.
- ^ Tessum, Christopher W.; Apte, Joshua S.; Good kind, Andrew L.; Muller, Nicholas Z.; Mullins, Kimberley A.; Paolella, David A.; Polasky, Stephen; Springer, Nathaniel P.; Thakrar, Sumil K. (2019-03-11). "Inequity in consumption of goods and services adds to racial–ethnic disparities in air pollution exposure". Proceedings of the National Academy of Sciences. 116 (13): 6001–6006. Bibcode:2019PNAS..116.6001T. doi:10.1073/pnas.1818859116. ISSN 0027-8424. PMC 6442600. PMID 30858319.
- ^ American Lung Association. (n.d.). How healthy is the air you breathe? Retrieved March 20, 2019, from lung.org
- ^ "History of ozone in Colorado". Colorado Department of Public Health & Environment. Retrieved 2023-04-18.
- ^ أ ب ت Evans, Jason M.; Helmig, Detlev (February 2017). "Investigation of the influence of transport from oil and natural gas regions on elevated ozone levels in the northern Colorado front range". Journal of the Air & Waste Management Association. 67 (2): 196–211. Bibcode:2017JAWMA..67..196E. doi:10.1080/10962247.2016.1226989. ISSN 1096-2247. PMID 27629587.
- ^ Colorado Department of Public Health and Environment, Regional Air Quality Council, & North Front Range Metropolitan Planning Organization. "Colorado Ozone Action Plan" (PDF). Retrieved 2019-03-21.
- ^ Colorado Department of Public Health and Environment. (n.d.). Colorado Air Quality. Retrieved March 20, 2019, from https://www.colorado.gov/airquality/air_quality.aspx
- ^ Layer, Robert W.; Lattimer, Robert P. (July 1990). "Protection of Rubber against Ozone". Rubber Chemistry and Technology. 63 (3): 426–450. doi:10.5254/1.3538264.
- ^ Yu, Xinyuan; Fiore, Arlene M.; Santer, Benjamin D.; Correa, Gustavo P.; et al. (2 August 2024). "Anthropogenic Fingerprint Detectable in Upper Tropospheric Ozone Trends Retrieved from Satellite". Environmental Science and Technology. 58 (32): 14306–14317. Bibcode:2024EnST...5814306Y. doi:10.1021/acs.est.4c01289. PMC 11325641. PMID 39092829.
{{cite journal}}: Check|pmc=value (help); Check|pmid=value (help) Further explained by Chu, Jennifer (2 August 2024). "Scientists find a human 'fingerprint' in the upper troposphere's increasing ozone". Phys.org. Archived from the original on 2 August 2024. - ^ "Tropospheric Ozone in EU – The consolidated report". European Environmental Agency. 1998. Retrieved 2006-05-10.
- ^ "Atmospheric Chemistry and Greenhouse Gases". Intergovernmental Panel on Climate Change. Archived from the original on 2006-07-10. Retrieved 2006-05-10.
- ^ "Climate Change 2001". Intergovernmental Panel on Climate Change. 2001. Archived from the original on 2006-09-13. Retrieved 2006-09-12.
- ^ Life Cycle Assessment Methodology Sufficient to Support Public Declarations and Claims, Committee Draft Standard, Version 2.1. Scientific Certification Systems, February 2011. Annex B, Section 4.
- ^ NASA GODDARD HOMEPAGE FOR TROPOSPHERIC OZONE NASA Goddard Space Flight Center Code 613.3, Chemistry and Dynamics Branch. Acdb-ext.gsfc.nasa.gov (2006-09-20). Retrieved on 2012-02-01.
- ^ Liu, Wei; Hegglin, Michaela I.; Checa-Garcia, Ramiro; Li, Shouwei; Gillett, Nathan P.; Lyu, Kewei; Zhang, Xuebin; Swart, Neil C. (April 2022). "Stratospheric ozone depletion and tropospheric ozone increases drive Southern Ocean interior warming". Nature Climate Change (in الإنجليزية). 12 (4): 365–372. Bibcode:2022NatCC..12..365L. doi:10.1038/s41558-022-01320-w. ISSN 1758-6798. S2CID 247844868.
Lay summary report: "Ozone may be heating the planet more than we realize". University of Reading (in الإنجليزية). Retrieved 19 April 2022. - ^ هيام بيرقدار، حسن حلمي خاروف. "الأوزون". الموسوعة العربية. Retrieved 2012-03-01.
- ^ "انغلاق أكبر ثقب بالأوزون على الإطلاق فوق القطب الشمالي".
مراجع للإستزادة
- مجلة العلوم، المجلد4، العدد3، مارس/آذار 1988، الكويت.
- مجلة العلوم، المجلد7، العدد3، مارس/آذار 1990، الكويت.
- حماية الأوزون (مجلة)، الأعداد 4، 7، 8، 11، 1993.
- معهد مراقبة البيئة العالمية Worldwatch
وصلات خارجية
- International Ozone Association
- European Environment Agency's near real-time ozone map (ozoneweb)
- NASA's Ozone Resource Page Archived 2013-04-06 at the Wayback Machine
- OSHA Ozone Information Archived 2016-01-20 at the Wayback Machine
- Paul Crutzen Interview—Video of Nobel Laureate Paul Crutzen talking to Nobel Laureate Harry Kroto by the Vega Science Trust
- NASA's Earth Observatory article on Ozone
- International Chemical Safety Card 0068
- NIOSH Pocket Guide to Chemical Hazards
- National Institute of Environmental Health Sciences, Ozone Information
- NASA Study Links "Smog" to Arctic Warming—NASA Goddard Institute for Space Studies (GISS) study shows the warming effect of ozone in the Arctic during winter and spring.
- Ground-level ozone information from the American Lung Association of New England
- CS1 errors: DOI
- CS1: Julian–Gregorian uncertainty
- CS1 errors: PMC
- CS1 errors: PMID
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Missing redirects
- ECHA InfoCard ID from Wikidata
- GHS errors
- Articles containing unverified chemical infoboxes
- Chemical articles with unknown parameter in Chembox
- Pages including recorded pronunciations
- مقالات ذات عبارات محل شك
- Articles containing Greek-language text
- Portal-inline template with redlinked portals
- Pages with empty portal template
- Ozone
- Air pollution
- Allotropes of oxygen
- Disinfectants
- Environmental chemistry
- Gases with color
- Greenhouse gases
- Industrial gases
- Odor
- Oxidizing agents
- Pollution
- مركبات أكسجين
- الصفحات التي تستخدم تنسيقا مهملا للعلامات الكيميائية

























![{\displaystyle V={\frac {K_{obs}\cdot [{\ce {O3}}]^{2}}{[{\ce {O2}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bbdc85228ea9c7fbc11d2763a9521840d5f520ad)




![{\displaystyle V_{1}=K_{1}\cdot [{\ce {O3}}]\qquad V_{2}=K_{2}\cdot [{\ce {O}}]\cdot [{\ce {O3}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa89c5e2c3b0c501381aadcdaa39b60594d1b4c7)

![{\displaystyle K_{eq}={\frac {K_{1}}{K_{-1}}}={\frac {[{\ce {O2}}]\cdot [{\ce {O}}]}{[{\ce {O3}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec620096f28f63ee72d87c8d3dd6f35023895cf5)
![{\displaystyle [{\ce {O}}]={\frac {K_{1}\cdot [{\ce {O3}}]}{K_{-1}\cdot [{\ce {O2}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98fafe6a7ff5c5725717421d2ad60788083ee4d8)
![{\displaystyle V={K_{2}\cdot K_{1}\cdot [{\ce {O_3}}]^{2} \over K_{-1}\cdot [{\ce {O_2}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3ddc5624b3b747072e94cfe8ea36a3269d56b7c2)
![{\displaystyle V={K_{\text{obs}}\cdot [{\ce {O_3}}]^{2} \over [{\ce {O_2}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b555dc7a5e0c1d64bd023030c58753cc0704c24)











![{\displaystyle {\ce {O2->[{\ce {photon}}][({\ce {radiation}}\ \lambda \ <\ 240\ {\ce {nm}})]2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/22c15c0d1b053ba02c27ceed129794d2cb91dd2a)