حمض الهيپوكلوروز
| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
حمض الهيپوكلوروز, كلورانول, الهيپوكلورين
| |
| أسماء أخرى
hydrogen hypochlorite
كلورات الهيدروجين (I) | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ECHA InfoCard | 100.029.302 |
| رقم EC |
|
CompTox Dashboard (EPA)
|
|
| |
| الخصائص | |
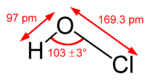
| الصيغة الجزيئية | HClO |
| كتلة مولية | 52.46 g/mol |
| المظهر | colorless aqueous solns |
| الكثافة | variable |
| قابلية الذوبان في الماء | soluble |
| الحموضة (pKa) | 7.497[1] |
| المخاطر | |
| خطر رئيسي | oxidizer |
| مركبات ذا علاقة | |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
حمض الهيپوكلوروز هو حمض ضعيف غير العضوية، ويتكون بإضافة الكلور إلى الماء. كما أنه يتسم بعدم الاستقرار، ويتحلل بسرعة عند تعرضه للحرارة أو الضوء. ويُستعمل هذا الحمض في أغراض منزلية مثل قصر (تبييض) الملابس والتطهير. ويعتقد الكيميائيون أنه عند إضافة الكلور إلى حمامات السباحة وموارد المياه يتكون هذا الحمض الذي يقتل البكتيريا. وعند تعادل حمض الهيبوكلوروز تتكون أملاح تسمى تحت الكلوريتات (هيبوكلوريتات). ويُذكر أن كلاًّ من هذا الحمض وأملاحه تعتبر عوامل أكسدة قوية. [2] ش يعد حمض الهيبوكلوروز أضعف أحماض الكلور. وصيغته الجزئية HOC1، ولكنها تكتب أحياناً HC1O. وهذا الحمض غير مستقر نسبيًّا، ولا يمكن عزله في شكل نقي، وإنما يوجد عادة في شكل محلول مخفف من HOC1 في الماء.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التركيب
- Cl2 + H2O HClO + HCl
الاستعمالات
التفاعلات الكيميائية
In aqueous solution, hypochlorous acid partially dissociates into the anion hypochlorite ClO-:
- HClO OCl- + H+
Salts of hypochlorous acid are also called hypochlorites. One of the best-known hypochlorites is NaOCl, the active ingredient in bleach.
In the presence of sunlight, hypochlorous acid decomposes into hydrochloric acid and oxygen, so this reaction is sometimes seen as:
- 2Cl2 + 2H2O 4HCl + O2
HClO is considered to be a stronger oxidant than chlorine.
HClO reacts with HCl to form chlorine gas:
HClO + HCl → H2O + Cl2
تفاعل الهيبوكلوروز مع الجزيئيات البيولوجية
Reaction with protein sulfhydryl groups
Reaction with protein amino groups
التفاعل مع الدنا والنيوكلوتيدات
التفاعل مع الدهون
عمله كمطهر
تثبيط أكسدة الگولكوز
Depletion of adenine nucleotides
تثبيط تكرار الدنا
Protein Unfolding and Aggregation
الأمان
يعتبر حمض الهيبوكلوروز مؤكسد قوي ويمكن أن يدخل ضمن الخلائط المتفجرة.
وصلات خارجية
المصادر
- ^ Morris, J. C. (1966), "The acid ionization constant of HClO from 5 to 35 °", J. Phys. Chem. 70: 3798–3805
- ^ الموسوعة المعرفية الشاملة