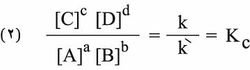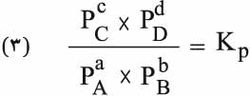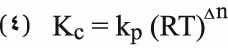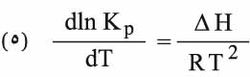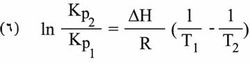توازن كيميائي
التوازن الكيميائي Chemical equilibrium في أي عملية كيميائية هي الحالة التي لايحدث فيها تغيرات بالنسبة للتفاعلات الكيميائية أو لتراكيز المواد المتفاعلة والمواد الناتجة. أي لا يوجد هناك تغير ملحوظ في الجملة.
نبذة من الأسس
ينشأ التوازن الكيميائي عندما تكون سرعة التفاعل بالاتجاه المباشر مساوية لمقابلتها في الاتجاه المعاكس وذلك بالنسبة للتفاعلات العكوسة، هذا لا يعني أن سرعةالتفاعل تساوي الصفر، إنما فقط تكون سرعة التفاعل في الاتجاه المباشر مساوية لسرعة التفاعل العكسي ، ويعبر عن ذلك بأن الجملة في حالة توازن تحريكي (توازن ديناميكي).
و يعتبر التوازن الكميائي أحد الشروط لتحقيق التوازن الترمودينامي.
ويقال عن جملة مؤلفة من مادة واحدة أو عدد من المواد إنها في حالة توازن كيميائي إذا لم تكن قادرة على القيام بأي تحول تلقائي في البنية الداخلية (حدوث تفاعل كيميائي) أو القيام بنقل المادة من جزء ما إلى أي جزء آخر منها (الانتشار في المحاليل).
ويكون التفاعل الكيميائي عكوساً (reversible) إذا جرى وفق اتجاهين متعاكسين، ويمكن أن تُعد جميع التفاعلات الكيميائية عكوسة، بيد أن هناك الكثير من التفاعلات يكون مدى التفاعل العكسي فيها من الصغر إلى حد يمكن إهماله، وبذلك تُعد هذه التفاعلات تامة، أي تحدث في اتجاه واحد. فإذا تفاعل، مثلاً، مزيج مؤلف من جزأين من الهيدروجين وجزء من الأكسجين في درجة الحرارة العادية بوساطة شرارة كهربائية كانت النتيجة تحول المزيج الغازي بكامله إلى ماء من دون بقاء أي كمية يمكن كشفها من الهدروجين أو الأكسجين، لذلك فتفاعل الهدروجين مع الأكسجين تفاعل تام في الشروط النظامية من الحرارة. ويمكن إعطاء كثير من الأمثلة على تفاعلات كيميائية مشابهة في السلوك للتفاعل السابق مثل تفاعلات الاحتراق وتفاعلات التعديل (حمض + أساس) وتفاعلات المعادن مع الحموض وغيرها؛ أما إذا سمحت الشروط لكل من التفاعل الأمامي (المباشر) (forward reaction) والتفاعل الخلفي (الرجعي) (backward reaction) بالحدوث بمقدار محسوس، فإن العملية تُعد تفاعلاً عكوساً. وهكذا ما أن يبدأ التفاعل الأمامي بالحدوث حتى تتجمع المواد الناتجة وتبدأ بالتفاعل عاكسة العملية الأمامية ومعطية المواد المتفاعلة من جديد، ومن ثم لا يمكن لأي من التفاعلين الأمامي أو الخلفي أن يحدث بصورة تامة. وقد وجد أنه بعد مضي وقت كاف تصل جميع التفاعلات العكوسة إلى حالة توازن كيميائي، أي إلى حالة لا يحدث فيها أي تغير في تكوين المزيج المتفاعل مع مرور الزمن شريطة عدم تغير درجة الحرارة والضغط. ويمكن إذا ما اختيرت الشروط اختياراً مناسباً الوصول إلى حالة التوازن ذاتها بغض النظر عن الجهة التي يبدأ منها بإجراء التفاعل العكوس. وتُعد أسترة الكحول بوساطة حمض كربوكسيلي مثالاً تاريخياً على التفاعلات العكوسة التي أجراها برتوليه Berthelot ول. پيان دو سان جيل L. Pean de Saint-Gilles عام 1861. يلاحظ عند مزج مول واحد من الإيتانول (الكحول الإيثيلي) مع مول واحد من حمض الخل أن تفاعل الأسترة الذي يحدث في الدرجة 100س يتوقف عند بقاء مول من الحمض والكحول المتفاعلين مع مول من خلات الإيتيل والماء الناتجين. ومن جهة أخرى، إذا تفاعل في درجة الحرارة السابقة ذاتها مول واحد من خلات الإيتيل مع مول واحد من الماء فإن تفاعل الحلمهة يتوقف عند تكوين للمزيج يوافق تماماً التكوين المذكور سابقاً. وهكذا يعد تفاعلا الأسترة والحلمهة عكوسين، ويعد مزيج المواد الأربع ذو التكوين السابق متوازناً كيميائياً. وبما أن تكوين الجملة المتوازنة لا يعاني أي تغير إذا لم يتغير الضغط ودرجة الحرارة لذلك يكون هناك احتمالان: الأول هو أن التفاعل الكيميائي قد توقف تماماً؛ والثاني هو أن التفاعل الأمامي والتفاعل الخلفي يحدثان في الوقت ذاته وبالسرعة نفسها. إن الاحتمال الثاني هو الاحتمال المقبول علمياً، لذلك يقال إن الجملة موجودة في حالة توازن تحريكي (dynamic equilibrium).
يستخدم للدلالة على المساواة بين جزيئات أو ذرات المواد المتفاعلة والناتجة في التفاعل الكيميائي التام سهم واحد كما في المثال الآتي:
في حين يستعمل في التفاعل الكيميائي العكوس سهمان متعاكسان كالآتي:
وتجدر الإشارة إلى أن هناك تفاعلات مثل تفاعل احتراق الهدروجين في الأكسجين تكون تامة عندما تحدث في درجة الحرارة العادية وتصبح عكوسة في درجات مرتفعة من الحرارة.
قانون فعل الكتلة
توفر فرضية التوازن الحركي طريقة بسيطة لتعيين العلاقة بين كميات المواد المتفاعلة والمواد الناتجة الموجودة في حالة توازن. تدعى هذه العلاقة قانون فعل الكتلة (law of mass action)، وقد توصل إليه الكيميائيان النرويجيان كاتو كولدبرگ C. Guldberg و پيتر واگه P. Waage عام 1864. فقد بحث هذان العالمان تأثير تركيز المواد المتفاعلة على سرعة التفاعل فوجدا أن سرعة التفاعل الكيميائي تتناسب طرداً مع التراكيز الموليَة لهذه المواد. فإذا ما أخذ بالحسبان تفاعل عكوس عام تقوم فيه a مولاً من المادة A بالتفاعل مع b مولاً من المادة B منتجة c مولاً من المادة C وd مولاً من المادة D وفق الآتي:
- α A + β B
 σ S + τ T
σ S + τ T
ينتج أن سرعة التفاعل الأمامي تتناسب مع التراكيز الموليَة للمادتين A وB، فإذا فرض أن ثابت التناسب هو k أمكن عندئذ كتابة المعادلة التالية:
سرعة التفاعل الأمامي و سرعة التفاعل الخلفي
حيث يرمز [A] و[B] إلى التركيز الموليَ للمادتين A وB. وتكتب بصورة مشابهة المعادلة الآتية للتفاعل الخلفي الذي تتناسب سرعته مع التركيزين الموليَين للمادتين C وD وترمز k لثابت التناسب الجديد:
where A, B, S and T are active masses and k+ and k− are rate constants. Since at equilibrium forward and backward rates are equal:
and the ratio of the rate constants is also a constant, now known as an equilibrium constant.
وتكون سرعة التفاعل الأمامي في حالة التوازن مساوية سرعة التفاعل الخلفي، لذلك يكتب:
وتجدر الإشارة إلى أن التراكيز المبينة في المعادلة السابقة هي التراكيز المقيسة في حالة التوازن. وتكتب المعادلة السابقة عادة على النحو الآتي:
تدعى العلاقة (2) قانون فعل الكتلة، ويدعى Kc ثابت توازن التفاعل الكيميائي (1) وهو ثابت لا يتعلق إلا بدرجة الحرارة، ويبين الدليل c أن الثابت يتعلق بحساب تركيز المواد بدلالة المول في اللَتر. أما إذا أخذت الضغوط الجزئية للدلالة على التركيز فيكتب قانون فعل الكتلة على النحو:
وتكون العلاقة بين Kc وKp كما يأتي:
حيث يرمز R إلى ثابت الغاز الكامل وT إلى درجة حرارة التفاعل المطلقة و∆n إلى الفرق بين مجموع عدد مولات المواد الموجودة إلى يمين التفاعل والمواد الموجودة إلى يساره، كما تبينه المعادلة الكيميائية الممثلة للتفاعل. وتبين المعادلة (4) أن ثابت التوازن Kp كالثابت Kc يتعلق فقط بدرجة الحرارة. كما يتضح من المعادلة (2) أو من المعادلة (3) أنه عندما تكون قيمة ثابت التوازن صغيرة جداً 1>>K (Kc أو Kp) فإن صورة (بسط) عبارة فعل الكتلة تكون أصغر من المخرج (المقام) وهذا يعني أنه عند استتباب التوازن يكون تركيز إحدى المواد (على الأقل) الموجودة إلى يمين المعادلة الكيميائية (1) صغيراً، أي إن القيمة الصغيرة لثابت التوازن تدل على أن التفاعل لا يجري بدرجة كبيرة من اليسار إلى اليمين، وبعبارة أخرى يمكن القول إن مزج A مع B لا يعطي الكثير من C وD. أما إذا كان ثابت التوازن في درجة حرارة معينة كبيراً 1<<K فإنه يمكن أن يستنتج وفقاً لما سبق أن التفاعل في هذه الحالة يسير من اليسار إلى اليمين بصورة تامة تقريباً، أي إن مزج A مع B يؤدي عملياً إلى تحول كبير إلى C وD.
تتجلى أهمية الاستنتاجات السابقة في كونها تقود إلى علاقة محددة بين تراكيز الأجسام المتفاعلة وتراكيز الأجسام الناتجة في تفاعل عكوس بعد استتباب التوازن، فيلاحظ أنه مهما كانت الكميات الأولية للأصناف المتفاعلة A، B و...الخ. وأنه سواء أكانت كل المواد الناتجة C، D و...الخ.. موجودة أو غير موجودة في بداية التفاعل، فإن التراكيز في حالة التوازن يجب أن يرتبط بعضها مع بعضها الآخر بطريقة تكون فيها العلاقة (2) محققة. فإذا عرفت قيمة ثابت التوازن بإجراء تجربة واحدة في درجة حرارة معينة أصبح بالإمكان معرفة تكوين الجملة المدروسة في حالة التوازن من أجل أي حالة أولية في درجة الحرارة نفسها. وكذلك يمكن بمعرفة تابعية ثابت التوازن لدرجة الحرارة حساب قيمة هذا الثابت في أي درجة حرارة مطلوبة إذا ما عرفت قيمته في درجة حرارة معينة. تعطى هذه التابعية بعلاقة فانت هوف Van’t Hoff الآتية:
تشتق هذه المعادلة من المفهومات الترموديناميكية وتمثل ΔH الفرق بين مجموع إنطلبية المواد الناتجة عن التفاعل والمواد الداخلة فيه وتدعى حرارة التفاعل (heat of reaction) وتكون موجبة عندما يكون التفاعل ماصاً للحرارة (endothermic) وسالبة حين يكون التفاعل ناشراً للحرارة (exothermic). ويمكن مكاملة المعادلة (5) في الحالة الخاصة التي لا تتغير فيها ΔH إلا تغيراً بسيطاً حين تتغير درجة الحرارة، فينتج:
وكذلك يمكن مكاملة علاقة فانت هوف بسهولة عندما تكون ΔH تابعة لدرجة الحرارة بمعرفة السعات الحرارية (heat capacities) للمواد الكيميائية الموجودة في المزيج المتوازن.
قانون انزياح التوازن
تبين التجربة كما يبين قانون فعل الكتلة أن تكوين المزيج المتوازن لتفاعل عكوس يتأثر بتغير تركيز المواد المتفاعلة ودرجة الحرارة والضغط والحجم. لا يكون للمتحولين الأخيرين أي تأثير في حالة التفاعلات التي يكون فيها مجموع عدد مولات المواد الناتجة مساوياً مجموع عدد مولات المواد المتفاعلة كالتفاعل:
ويمكن حساب تأثير العوامل السابقة في تكوين المزيج المتفاعل المتوازن بصورة كمية استناداً إلى قوانين التحريك الحراري (الترموديناميك)، إلا أن هناك قاعدة ذات أساس ترموديناميكي سهلة التطبيق تعرف بمبدأ لوشاتوليه Le Chatelier تقود إلى استنتاجات كيفية فيما يتعلق بالجهة التي ينزاح إليها التفاعل إذا ما تغير أحد العوامل التي لها تأثير فيه. تنص هذه القاعدة على أنه «إذا حدث أي تغير في أحد العوامل التي تحدد توازن جملة متوازنة فإن هذه الجملة تميل إلى تعديل نفسها فتخفف بقدر الإمكان من تأثير هذا التغير». تتوضح هذه القاعدة بدراسة التأثيرات المختلفة على المثال الآتي (الناشر للحرارة):
أ - تأثير تغيير كمية أحد المكونات يجعل في هذه الحالة حجم الجملة ودرجة حرارتها ثابتين، ويضاف إلى الجملة المتوازنة كمية زائدة من الهدروجين مثلاً: تبين قاعدة لوشاتوليه أن زيادة الهدروجين تؤدي إلى انزياح التوازن في الاتجاه الذي يخفف من هذه الزيادة، أي تعدل الجملة نفسها بامتصاص تأثير الهدروجين المضاف، ويكون ذلك عن طريق اتحاد جزيئات الهدروجين مع الآزوت وإنتاج الأمونيا، وهكذا ينزاح التوازن من اليسار إلى اليمين. أما في حالة إضافة كمية جديدة من الأمونيا إلى المزيج المتوازن فإن التوازن ينزاح من اليمين إلى اليسار.
ويحدث الأمر ذاته إذا أُنقصت مثلاً كمية الأمونيا في المزيج المتوازن إذ ينزاح التوازن عندئذ في الاتجاه الذي يخفف من تأثير نقصان الأمونيا، ويتم ذلك بإنتاج كمية جديدة من الأمونيا عن طريق اتحاد الآزوت مع الهدروجين، أي ينزاح التوازن من اليسار إلى اليمين.
ب - تأثير تغير حجم الجملة أو ضغطها:
يُميز في هذه الحالة نوعان من التفاعلات، الأول هو التفاعلات التي يكون فيها مجموع عدد الجزيئات في يمين المعادلة الكيميائية مساوياً مجموع عدد الجزيئات في يسارها كالتفاعل (7)، إذ يلاحظ أن تغير حجم الجملة أو ضغطها لا تأثير له في تكوين المزيج المتفاعل المتوازن. أما النوع الثاني فيختلف فيه مجموع عدد الجزيئات في اليمين عن عددها في اليسار ومن ثم يكون لحجم الجملة أو ضغطها تأثير في التكوين.
وتفسر قاعدة لوشاتوليه هذه الظاهرة، بالقول إنه إذا ما أنقص حجم تفاعل متوازن، أدى ذلك إلى ازدحام الجزيئات في الحجم الجديد فينزاح التوازن إلى الجهة التي تخفف من الازدحام، أي الجهة التي تنقص عدد جزيئات الجملة بأكملها. ويتم ذلك في حالة التفاعل (8) عن طريق تكوين الأمونيا، لأن تكوُّن جزيئين من الأمونيا يستهلك أربعة جزيئات من الهدروجين والآزوت، ولذلك ينزاح التوازن من اليسار إلى اليمين. أما في التفاعل (7) فلا يكون هناك اتجاه يخفف من تأثير الازدحام ولذلك يبقى تكوين المزيج المتوازن ثابتاً لدى إنقاص الحجم.
أما تأثير الضغط فيكون معاكساً لتأثير الحجم، ولذلك يكتفى عادة بدراسة أحدهما، ويمكن القول إن زيادة الصغط تزيح التوازن بالاتجاه الذي يتكون فيه عدد أقل من جزيئات الغاز، ويحدث العكس إذا انخفض الضغط.
جـ - تأثير درجة الحرارة
يتبين من التفاعل (8) أن التفاعل الأمامي ينشر كمية من الحرارة قدرها كيلو حريرة نتيجة تكون مولين من الأمونيا بدءاً من مول واحد من الآزوت وثلاثة مولات من الهدروجين. أما التفاعل الخلفي فيمتص الكمية نفسها من الحرارة نتيجة تفكك المقدار نفسه من الأمونيا إلى آزوت وهدروجين. وتبين قاعدة لوشاتوليه أنه إذا ارتفعت درجة حرارة تلك الجملة المتوازنة فإنها تعدل نفسها بالإنقاص من مقدار هذا الارتفاع، ويتحقق ذلك بامتصاص الحرارة أي بانزياح التوازن من اليمين إلى اليسار.[1]
التعبير الرياضي
من أجل التفاعل
تكون سرعة التفاعل المباشر
وسرعة التفاعل العكسي
حيث:
- كميات المواد A, B, S , T المشتركة في التفاعل ،
k+ و k− ثوابت سرعة التفاعل المباشر وبالتالي التفاعل العكسي :
عند تساوي السرعات، تكون:
R1=R2
يُعبر عن النسبة بين ثوابت سرعة التفاعل بثابت التوازن
أنواع الاتزان وبعض تطبيقاتها
- في الطور الغازي. المحركات الصاروخية[2]
- التخليق الصناعي مثل الأمونيا في عملية هابر-بوش (بالصورة إلى اليسار) يحدث من خلال سلسلة من خطوات التوازن تضم عمليات امتزاز.
- كيمياء الغلاف الجوي
- مياه البحر والمياه الطبيعية الأخرى: علم المحيطات الكيميائي
- Distribution between two phases
Composition of an equilibrium mixture
When the only equilibrium is that of the formation of a 1:1 adduct as the composition of a mixture, there are any number of ways that the composition of a mixture can be calculated. For example, see ICE table for a traditional method of calculating the pH of a solution of a weak acid.
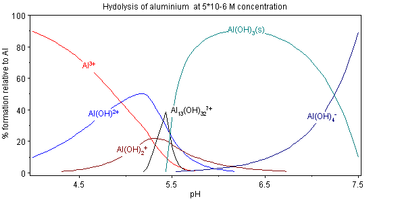
Composition for polybasic acids as a function of pH
The composition of solutions containing reactants A and H is easy to calculate as a function of p[H]. When [H] is known, the free concentration [A] is calculated from the mass-balance equation in A. Here is an example of the results that can be obtained.
مراجع
- ^ غدير زيزفون. "التوازن الكيمياوي". الموسوعة العربية.
- ^ NASA Reference publication 1311, Computer Program for Calculation of Complex Chemical Equilibrium Compositions and Applications