إمتريسيتابين
 | |
| البيانات السريرية | |
|---|---|
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | Oral |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية | |
| بيانات الحركية الدوائية | |
| التوافر الحيوي | 93% |
| ارتباط الپروتين | Very low (less than 4%) |
| الأيض | Hepatic oxidation and glucuronidation CYP system not involved |
| Elimination half-life | 10 hours |
| الإخراج | Renal (86%) and fecal (14%) |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| DrugBank | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.120.945 |
| Chemical and physical data | |
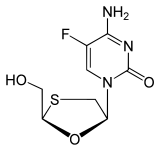
| التركيب | C8H10FN3O3S |
| الكتلة المولية | 247.248 g/mol |
إيمتريسيتابين Emtricitabine (FTC), إيمتريسيتابين بالإسم التجارى Emtriva (سابقا Coviracil), وهو nucleoside reverse transcriptase inhibitor (NRTI) لعلاج عدوى HIV للأطفال والكبار.
و يسوق أيضا إيمتريسيتابين بتركيب تابت الجرعة معtenofovir (Viread) تحت الإسم التجارىTruvada. وبتركيب ثلاثى emtricitabine, tenofovir and efavirenz (Sustiva, يسوق بواسطة by Bristol-Myers Squibb) وقد أقرتهFDA في 12 يولية, 2006 تحت الإسم النوعىAtripla.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
Emtricitabine أكتشف بواسطةDr. Dennis C. Liotta, . Raymond Schinazi و Dr. Woo-Baeg Choi ل Emory University و رخص ل Triangle Pharmaceuticals بواسطةEmory عام 1996.[1] Triangle Pharmaceuticals was acquired in 2003 by Gilead Sciences, who completed development and now market the product with the brand name Emtriva.
و تم إقراره بواسطة FDA يوليو2, 2003. وهو يشبه تماما 3TC و توجد مقاومة متبادلة بين العقارين .
طريقة العمل
Emtricitabine هوanalogueمنcytidine. يعمل العقار بتثبيطreverse transcriptase, ال الإنزيم الذى ينسخ HIV RNA الى فيروسي جديدDNA. بالتداخل مع هذه العملية , التى تعد مركزية لنسخ HIV, emtricitabine يمكن أن يساعد بتخفيض كمية HIV, or "viral load", في جسم المريض ويستطيع بطريق غيرمباشر زيادة عددimmune system خلايا (وتدعى T cells أو CD4+ T-cells). كلاهما التغييرات ترتبط بجهاز المناعة السوى بقابلية ضئيلة للآثار الجانبية الخطيرة .
دواعي الإستعمال
Emtricitabine is indicated in combination with other antiretroviral agents for the treatment of HIV infection in adults. This indication is based on the analyses of plasma HIV RNA levels and CD4 cell counts in two Phase III clinical trials of Emtriva of 48 weeks duration.
It is not indicated for the treatment of chronic hepatitis B virus infection and the safety and efficacy of emtricitabine have not been established in patients co-infected with HBV and HIV. Severe acute exacerbations of hepatitis B have been reported in patients after the discontinuation of emtricitabine. The drug is however being evaluated as a potential treatment for chronic hepatitis B. These studies are ongoing.
الآثار الجانبية
In clinical practice, toxicity with emtricitabine is unusual. The most common treatment-related adverse events are diarrhea, headache, nausea, and rash. These symptoms are generally mild to moderate in severity, but they caused 1% of clinical trial patients to give up treatment. Skin discoloration, which is typically reported as hyperpigmentation and usually affects either the palms of the hands or the soles of the feet, is reported in under 2% of individuals and is almost exclusive to patients of African origin.
Among the more severe side effects patients may experience are a hepatotoxicity or a lactic acidosis.
المراجع
الروابط الخارجية
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Articles without EBI source
- Chemical pages without ChemSpiderID
- Articles without KEGG source
- Articles without InChI source
- Articles without UNII source
- Articles containing unverified chemical infoboxes
- الأدوية الأساسية حسب منظمة الصحة العالمية
- گلعاد للعلوم
- مثبطات ترانسكريپتاز العكسي المضاهية للنيكليوسيد