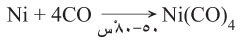نيكل
 | |||||||||||||||
| النيكل | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | رمادي فلزي ذو بريق ذهبي | ||||||||||||||
| الوزن الذري العياري Ar°(Ni) | |||||||||||||||
| النيكل في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 28 | ||||||||||||||
| المجموعة | 10 | ||||||||||||||
| الدورة | period 4 | ||||||||||||||
| المستوى الفرعي | d-block | ||||||||||||||
| التوزيع الإلكتروني | [Ar] 3d8 4s2 or [Ar] 3d9 4s1 (انظر النص) | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 16, 2 or 2, 8, 17, 1 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | صلب | ||||||||||||||
| نقطة الانصهار | 1728 K (1455 °س، 2651 °F) | ||||||||||||||
| نقطة الغليان | 3003 K (2730 °س، 4946 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 8.908 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 7.81 ج/سم³ | ||||||||||||||
| حرارة الانصهار | 17.48 kJ/mol | ||||||||||||||
| حرارة التبخر | 379 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 26.07 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| حالات الأكسدة | 4,[1] 3, 2, 1,[2] −1 | ||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 1.91 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 124 pm | ||||||||||||||
| نصف قطر التكافؤ | 124±4 pm | ||||||||||||||
| نصف قطر ڤان در ڤالز | 163 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| البنية البلورية | مكعب محوري الوجه | ||||||||||||||
| سرعة الصوت قضيب رفيع | 90.9 W/(m·K) | ||||||||||||||
| التمدد الحراري | 13.4 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 69.3 nΩ⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | مغناطيسي حديدي | ||||||||||||||
| معامل يونگ | 200 GPa | ||||||||||||||
| معامل القص | 76 GPa | ||||||||||||||
| معاير الحجم | 180 GPa | ||||||||||||||
| نسبة پواسون | 0.31 | ||||||||||||||
| صلادة موز | 4.0 | ||||||||||||||
| صلادة ڤيكرز | 638 MPa | ||||||||||||||
| صلادة برينل | 700 MPa | ||||||||||||||
| رقم كاس | 7440-02-0 | ||||||||||||||
| التاريخ | |||||||||||||||
| الاكتشاف | Axel Fredrik Cronstedt (1751) | ||||||||||||||
| أول عزل | Axel Fredrik Cronstedt (1751) | ||||||||||||||
| نظائر الالنيكل | |||||||||||||||
| قالب:جدول نظائر النيكل غير موجود | |||||||||||||||
النيكل Nickel، هو عنصر كيميائي له الرمز Ni والعدد الذري 28 في الجدول الدوري للعناصر، وهو فلز أبيض فضي بمظهر ذهبي خفيف. ينتمي النيكل إلى المعادن الانتقالية وهو صلب ومطيل. كما يُظهر النيكل النقي، المسحوق لزيادة تفاعل مساحة السطح إلى الحد الأقصى، نشاطاً كيميائياً واضحاً، لكن القطع الأكبر بطيئة في التفاعل مع الهواء تحت الظروف القياسية لأن طبقة أكسيد تتشكل على السطح وتمنع المزيد من التآكل ( التخميل). ومع ذلك، يوجد النيكل النقي الأصلي في قشرة الأرض بكميات ضئيلة فقط، عادةً في صخر فوق مافي،[3][4] وفي الأجزاء الداخلية من نيازك حديد-نيكل الكبيرة التي لم تتعرض للأكسجين عندما تكون خارج الغلاف الجوي للأرض.
عُثر على النيكل النيزكي في تركيبة مع الحديد، وهو انعكاس لأصل هذه العناصر كمنتجات نهائية رئيسية للتخليق النووي في المستعر الأعظم. يُعتقد أن خليط الحديد والنيكل يؤلف الجزء الخارجي و الداخلي للأرض.[5]
أُرجع استخدام النيكل (باعتباره سبيكة نيزكية طبيعية من النيكل والحديد) إلى3500 BCE. وقد عُزل النيكل لأول مرة وصُنّف كعنصر كيميائي في 1751 من قبل أكسل فريدريك كرونستيد، الذي أخطأ في البداية في أن الخام معدن نحاسي، في مناجم الكوبالت في لوس، هالسينگلاند، السويد. ويأتي اسم العنصر من شبح مؤذ من أساطير عمال المناجم الألمانية، نيكل (مثل نيك القديم، الذي جسد حقيقة أن خامات النحاس والنيكل قاومت صقل النحاس. المصدر المهم اقتصادياً للنيكل هو خام الحديد الليمونيت، والذي يحتوي غالباً على 1-2٪ نيكل. كما تشمل معادن خام النيكل المهمة الأخرى پنتلانديت ومزيج من السيليكات الطبيعية الغنية بالنيكل والمعروفة باسم الگارنيريت. وتشمل مواقع الإنتاج الرئيسية منطقة سودبيري في كندا (التي يُعتقد أنها من أصل نيزكي)، كاليدونيا الجديدة في المحيط الهادئ ونوريلسك في روسيا.
يتأكسد النيكل ببطء بواسطة الهواء عند درجة حرارة الغرفة ويعتبر مقاوماW للتآكل. تاريخياً، استُخدام لطلاء الحديد والنحاس، ومعدات الطلاء الكيميائية، وتصنيع بعض السبائك التي تحتفظ بطلاء فضي عالي، مثل الفضة الألمانية. ولا يزال حوالي 9٪ من إنتاج النيكل العالمي يستخدم في طلاء النيكل المقاوم للتآكل. كما تثير الأجسام المطلية بالنيكل أحياناً حساسية النيكل. ويستخدم النيكل على نطاق واسع في العملات المعدنية، على الرغم من أن ارتفاع سعره أدى إلى استبداله بمعادن أرخص في السنوات الأخيرة.
النيكل هو أحد العناصر الأربعة (العناصر الأخرى هي الحديد والكوبالت والگادولينيوم)[6]والتي تكون مغناطيسية حديدية عند درجة حرارة الغرفة تقريباً. كما يعتمد مغناطيس النيكو الدائم جزئياً على النيكل له قوة وسيطة بين مغناطيس دائم قائم على الحديد وجاذبية الأرض المغناطيسية. يعد المعدن ذا قيمة في العصر الحديث بشكل رئيسي في السبائك؛ يستخدم حوالي 68٪ من الإنتاج العالمي في الفولاذ المقاوم للصدأ. يتم استخدام 10٪ إضافية للسبائك القائمة على النيكل والنحاس، و7٪ لسبائك الفولاذ، و3٪ في المسابك، و9٪ في الطلاء و4٪ في التطبيقات الأخرى، بما في ذلك قطاع البطاريات سريع النمو،[7] بما في ذلك تلك الموجودة في المركبات الكهربائية (EVs).[8] كمركب، يحتوي النيكل على عدد من الاستخدامات المتخصصة في التصنيع الكيميائي، مثل محفز الهدرجة، كاثودات للبطاريات القابلة لإعادة الشحن والأصباغ ومعالجة الأسطح المعدنية.[9] النيكل عنصر غذائي أساسي لبعض الكائنات الحية الدقيقة والنباتات التي تحتوي على إنزيمات مع وجود النيكل كمحفز.[10]
الخواص
الخصائص الذرية والفيزيائية
النيكل فلز ذو لون أبيض فضي لامع، ينتمي إلى الفلزات الانتقالية وهو أحد المواد الاربعة المغناطيسية في درجات الحرارة والضغوط العادية. فلز النيكل قاسٍ وقابل للطرق. يوجد غالباً في الطبيعة مع الكبريت و الحديد في البنتلاندايت أو الكبريت في الميلليرايت أو الزرنيخ والكبريت في النيكل جالينا أو مع الخارصين في المناجم.
النيكل عنصر نشيط كيمائياً بشكله الحر، فيتفاعل مع أكسجين الهواء الجوي ببطىء في درجات الحرارة والضغوط العادية مشكلاً طبقة عازلة من الأكسيد على السطح تخفف من مدى النشاط الكيميائي كما هي الحال بالنسبة لعناصر الكروم والألومنيوم والتيتانيوم. لهذا السبب يستعمل النيكل غالباً في عمليات الطلي المعدني كالحديد والنحاس الأصفر و في سك العملات المعدنية، وفي صناعة الأجهزة المخبرية والطبية والكيميائية أيضاً وفي أنواع محددة من السبائك كسبيكة الفضة الألمانية.
يعتبر النيكل عنصرا هاما في السبائك التي يكونها خصوصا السبائك الفائقة مثل وتحديدا الفولاذ الغير قابل للصدأ.
يعد النيكل متوسط النشاط الكيمياوي فهو يقع بين الحديد والقصدير في الترتيب الكهرحركي، فهو في الشروط العادية يتفاعل بدرجة تكاد لا تذكر مع اللامعادن النموذجية والجافة مثل الأكسجين والكبريت والكلور والبروم، كما أنه ينحل بدرجة أقل من الحديد في الحموض الممددة إلا أن حمض الآزوت المركّز أشد تفاعلاً مع النيكل. وهو لا يتأثر بالحالة المتراصة النقية بالهواء الجاف.
يتفكك الكربيد Ni3C عند درجات حرارة أعلى من درجة انصهار المعدن.
ويكوّن النيكل معقّدات منها K4[Ni(CN)4] وشكله رباعي وجوه، وK2[Ni(Cn)4] وهو ذو شكل مربع، و [Ni(SCN)6]-4 ذو شكل ثماني وجوه.
وللنيكل عدة أرقام أكسدة، أكثرها شيوعاً +2، بالإضافة إلى 0 و +1 و +3 و +4 والتي غالباً ما تلاحظ في معقدات النيكل ويظهر في بعض الأحيان بحالة التأكسد +6 ولكن هذا لم يتبين بشكل قاطع.
للنيكل خواص مغناطيسية بطبيعته، ويترافق وجوده غالباً مع الكوبالت، حيث يوجد كلاهما في الحديد الموجود في النيازك.
البنية الذرية للنيكل هي مكعب ذو معامل شبكي 0.352 نانومتر لذلك نصف قطره الذري 0.125 نانومتر.
الخلاف حول التوزيع الإلكتروني
تحتوي ذرة النيكل على نوعين من التوزيع الإلكتروني، [Ar] 3d8 4s2 و[Ar] 3d9 4s1، وهي قريبة جداً من الطاقة - يشير الرمز [Ar] إلى الأرگون - وهي بنية أساسية شبيهة. هناك بعض الخلاف حول التوزيع الذي يحتوي على أقل طاقة.[11] تقتبس كتب الكيمياء التوزيع الإلكتروني للنيكل مثل [Ar] 4s2 3d8،[12]والتي يمكن كتابتها أيضاً [Ar] 3d8 4s2.[13]يتوافق هذا التوزيع مع قاعدة ترتيب طاقة مادلنگ، التي تتوقع ملء 4s قبل 3d. وهي مدعومة بحقيقة تجريبية مفادها أن أقل حالة طاقة لذرة النيكل هي مستوى طاقة ثلاثي الأبعاد 3d8 4s2 ، وتحديداً المستوى 3d8(3F) 4s2 3F, J = 4.[14]
ومع ذلك، ينقسم كل من هذين التوزيعين إلى عدة مستويات طاقة بسبب البنية الدقيقة،[14] وتتداخل مجموعتا مستويات الطاقة. متوسط الطاقة للحالات ذات التكوين [Ar] 3d9 4s1 هو في الواقع أقل من متوسط الطاقة للحالات ذات التكوين [Ar] 3d8 4s2. لهذا السبب، فإن الأدبيات البحثية حول الحسابات الذرية تقتبس توزيع الحالة الأرضية للنيكل كـ [Ar] 3d9 4s1.[11]
النظائر
تتراوح نظائر النيكل في الوزن الذري من 48 u (48 Ni) إلى 78 u (78 Ni).[بحاجة لمصدر]
يتكون النيكل الموجود طبيعياً من خمسة نظائر مستقرة؛ 58 Ni، 60 Ni، 61 Ni، 62 Ni و64 Ni، مع 58 Ni الأكثر وفرة (68.077% وفرة طبيعية).[بحاجة لمصدر]
لدى نيكل-62 أعلى متوسط طاقة الربط النووي لكل نواة من أي نيوكليد، عند 8.7946 إلكترون فولت\نيوكليون.[15][16]طاقة الترابط الخاصة به أكبر من كل من 56 Fe و58 Fe، غالباً ما يتم الاستشهاد بالعناصر الأكثر وفرة بشكل غير صحيح على أنها تحتوي على النويدات الأكثر إحكاماً.[17]على الرغم من أن هذا قد يبدو أنه يتنبأ بالنيكل -62 باعتباره أكثر العناصر الثقيلة وفرة في الكون، إلا أن المعدل المرتفع نسبياً للتحلل الضوئي للنيكل في الأجزاء الداخلية النجمية يتسبب في أن يكون الحديد هو الأكثر وفرة إلى حد بعيد.[17]
النظير المستقر النيكل-60 هو نتاج النويدات المشعة الهامدة 60 Fe، والذي يتحلل مع عمر نصف يبلغ 2.6 مليون سنة. نظراً لأن 60 Fe لها عمر نصف طويل فإن ثباتها في المواد في النظام الشمسي قد تولد اختلافات ملحوظة في التركيب النظيري لـ 60 Ni. لذلك، قد توفر وفرة 60 Ni الموجودة في مادة خارج كوكب الأرض نظرة ثاقبة لأصل النظام الشمسي وتاريخه المبكر.[بحاجة لمصدر]
وُصف ما لا يقل عن 26 نيوكليد مشع للنيكل، وأكثرها استقراراً هو 59 Ni مع عمر النصف 76000 عام، 63 Ni بـ100 عام و56 Ni بـ 6 أيام. جميع النظائر المشعة المتبقية لها فترات عمر نصف أقل من 60 ساعة ومعظم هذه النظائر لها نصف عمر أقل من 30 ثانية. كما يحتوي هذا العنصر أيضاً على مصاوغ نووي.[18]
يُنتج النيكل-56 المشع بواسطة عملية احتراق السليكون ويتم تحريره لاحقاً بكميات كبيرة أثناء المستعر الأعظم النوع Ia. كما يتوافق شكل المنحنى الضوئي لهذه المستعرات الأعظمية في الأزمنة المتوسطة إلى المتأخرة مع الانحلال عبر التقاط الإلكترون للنيكل 56 إلى كوبالت-56 وفي النهاية إلى الحديد 56.[19] النيكل 59 مادة طويلة العمر نيوكليدات مشعة كونية يبلغ عمرها النصف 76000 سنة. ووجد 59 Ni العديد من التطبيقات في جيولوجيا النظائر. تم استخدام 59 Ni لتاريخ العمر الأرضي للنيازك ولتحديد وفرة الغبار خارج كوكب الأرض في الجليد والرواسب. تم قياس عمر النصف للنيكل 78 مؤخراً عند 110 مللي ثانية، ويُعتقد أنه نظير مهم في التخليق النووي في المستعر الأعظم لعناصر أثقل من الحديد.[20] النيوكليد 48Ni، المكتشف عام 1999، هو أكثر نظائر العناصر الثقيلة غنى بالبروتون المعروفة. مع 28 بروتون و20 نيوترون، يكون 48Ni "doubly magic"، كما هو الحال مع 78 Ni مع 28 بروتوناً و50 نيوترون. لذلك فإن كلاهما مستقر بشكل غير عادي بالنسبة للنويدات ذات التوازن المختل بين البروتون والنيوترون.[18][21]
النيكل-63 ملوث موجود في الهيكل الداعم للمفاعلات النووية. يتم إنتاجه من خلال التقاط النيوترون بواسطة النيكل-62. كما تم العثور على كميات صغيرة بالقرب من مواقع تجارب الأسلحة النووية في جنوب المحيط الهادئ.[22]
التواجد

صادف في الطبيعة على شكل كبريتيد مخلوطاً مع ضروب الكبريتيدات الأخرى (مثال ذلك الميلّريت millerite NiS) والبنتلانديت NiS.FeS والكوبلتيت CoAsS، ومع الزرنيخيدات، والأنتموانيدات الأخرى. ومن المعتقد حالياً أن الحديد والنيكل هما العنصران الرئيسيان اللذان يشكلان نواة الكرة الأرضية.[23]
تكمن صعوبة استحصاله في فصله عن الكوبلت الذي غالباً ما يكون مرافقاً له، وفي فصل العنصرين عن العناصر المرافقة.
يحمَّص خامه فيتحول إلى أكسيد النيكل NiO ويرجَع (يختزل) الأكسيد بالهدروجين:
وللحصول على النيكل نقياً يسخَّن مع أكسيد الكربون فيتكون كربونيل النيكل:
وبتسخين الكربونيل عند الدرجة 180 ْس يُحصل على النيكل النقي (طريقة موند Mond):
للنيكل البنية الإلكترونية: [Ar]4s32d8 وتدل [Ar] على البنية الإلكترونية للغاز الخامل الأرگون؛ كتلته الذرية النسبية 69.58، درجة انصهاره 1453 ْس، ودرجة غليانه 2732 ْس، كتلته الحجمية 8.90غ/سم3، كمون المسرى (Ni2+/Ni) يساوي - 0.25 فولط. أي إنه أعلى من الهدروجين في الترتيب الكهرحركي. نصف قطر ذرته 1.24 أنگستروم.
يستعمل النيكل حفّازاً (وسيطاً) catalyst كما يدخل في صناعة الزجاج (الأخضر)، ويستخدم في صنع مدخرة «بطارية» النيكل وهي منبع للتيار الكهربائي وفرق الكمون فيها 1.2 فولط. والتفاعل فيها:
وعند الشحن يُرجَع Fe(OH)2 إلى Fe ويتأكسد هدروكسيد النيكل Ni(OH)2 متحولاً إلى Ni2O3. وزن المدخرة خفيف، ومردود التيار فيها منخفض وهي أغلى من المدخرات الرصاصية.
المركبات
معظم أملاح الحموض القوية منحلة بالماء وتكون محاليلها ذات تفاعل حمضي ضعيف بسبب الحلمهة (التحلل بالماء). أما أملاح الحموض الضعيفة فغالباً تكون صعبة الانحلال مثل الكربونات والفوسفات. ولون Ni2+ أصفر؛ أما الأيون المميه فله لون أخضر زاهي مميّز.
هاليداته MX2 هيX) هي F، أو Cl، أو Br، أوI ( ويحصل عليها بتفاعل النيكل مع الحمض الموافق. وهي تنحل جيداً في الماء وفي الكحول باستثناء الفلوريد. ويختلف لونها في الحالة اللامائية حسب الهالوجين. وتشكل الهاليدات معقدات صيغتها العامة: A[NiX3]، A2[NiX4] حيث A أيون معدن قلوي أو أيون أمونيوم.
كبريتات النيكل NiSO4 تتبلور مع 7 جزيئات ماء أو 6 جزيئات. ويحضر ملح الكبريتات بتفاعل النيكل مع حمض الكبريت الممدد. وملح كبريتات النيكل والأمونيوم Ni(NH4)2(SO4)2.6H2O أزرق مخضر، يستعمل بالطلي الغلفاني.
النيكل (0)
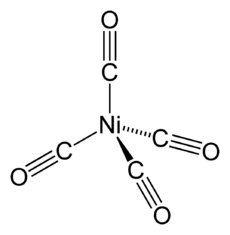
اكتُشف رباعي كربونيل النيكل (Ni(CO) 4)، من قبل لودڤيگ موند،[24] وهو سائل متطاير شديد السمية في درجة حرارة الغرفة. عند التسخين، يتحلل المركب مرة أخرى إلى النيكل وأول أكسيد الكربون:
- Ni(CO) 4
 Ni + 4 CO
Ni + 4 CO
يُستغل هذا السلوك في عملية موند لتنقية النيكل كما هو موضح أعلاه. إن مركب النيكل (0) المرتبط مضاعف (سيكلوكتاديين) نيكل (0) هو محفز مفيد في النيكل الكيميائي العضوي لأنه يمكن إزاحة روابط حلقي الأوكتادايين (أو "كود") بسهولة.
النيكل (I)
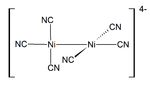
مركبات النيكل (I) غير شائعة، ولكن أحد الأمثلة على ذلك هو مجمع رباعي السطوحNiBr(PPh3)3. تتميز العديد من مركبات النيكل (I) برابطة Ni-Ni، مثل اللون الأحمر الداكن المغناطيسي المعاكس K 4[Ni 2(CN) 6] المُعد بتقليل K 2[Ni 2(CN) 6] مع ملغمة الصوديوم. كما يتأكسد هذا المركب في الماء ويتحرر H 2.[25]
يُعتقد أن حالة أكسدة النيكل (I) مهمة للإنزيمات المحتوية على النيكل، مثل [NiFe]-هيدروجيناز، والتي تحفز الاختزال القابل للانعكاس للبروتونات إلى H 2.[26]
النيكل (II)

يشكل النيكل (II) مركبات تحتوي على جميع الأنيونات الشائعة، بما في ذلك الكبريتيد، كبريتات، وكربونات، وهيدروكسيد، وكربوكسيلات، وهاليدات. يتم إنتاج كبريتات النيكل (II) بكميات كبيرة عن طريق إذابة معدن النيكل أو أكاسيده في حامض الكبريتيك، مكوناً كلاً من سداسي وهيبتاهيدراتي[27] المفيد للنيكل الطلاء الكهربائي. كما تذوب أملاح النيكل الشائعة، مثل الكلوريد والنترات والكبريتات في الماء لتعطي محاليل خضراء من مركب المعادن المائي [Ni(H 2O) 6]2+ .
تشكل الهاليدات الأربعة مركبات نيكل، وهي مواد صلبة بها جزيئات تتميز بمراكز نيكل ثماني السطوح. كلوريد النيكل (II) هو الأكثر شيوعاً، وسلوكه يوضح الهاليدات الأخرى. ينتج كلوريد النيكل (II) عن طريق إذابة النيكل أو أكسيده في حمض الهيدروكلوريك. عادة ما يتم مواجهتها على أنها سداسي الهيدرات الأخضر، وعادة ما يتم كتابة صيغتها NiCl2•6H2O. عندما يذوب في الماء، يشكل هذا الملح مركب معدني مائي [Ni(H 2O) 6]2+ . يعطي جفاف النيكل NiCl2•6H2O اللون الأصفر NiCl 2.
كما توجد مركبات النيكل رباعي التنسيق (II)، على سبيل المثال مضاعف (ثلاثي فينيل فوسفين) كلوريد النيكل، الفي كل من الأشكال الهندسية المستوية رباعية السطوح والمربعة. المجمعات الرباعية السطوح هي مغناطيسية مسايرة، بينما المجمعات المستوية المربعة مغناطيسية معاكسة. في وجود خصائص التوازن المغناطيسي وتشكيل المجمعات الاوكتاهدرا، فإنها تتناقض مع المجمعات ثنائية التكافؤ من مجموعة المعادن الثقيلة 10، والپلاديوم (II) والبلاتين (II)، والتي تشكل بنية مستوية مربعة فقط.[28]
يبلغ عدد إلكترونات النيكلوسين المعروف 20، مما يجعله غير مستقر نسبياً.
النيكل (III) و(IV)
العديد من مركبات Ni(III) معروفة، وأول هذه الأمثلة هو Nickel (III) trihalophosphines (NiIII(PPh3)X3).[29]علاوة على ذلك، يشكل Ni(III) أملاحاً بسيطة مع الفلورايد[30] أو أيونات الأكسيد. يمكن تثبيت Ni (III) بواسطة روابط مانحة σ مثل ثيول وفوسفين.[25]
يوجد Ni(IV) في الأكسيد المختلط BaNiO 3، بينما يوجد Ni(III) في هيدروكسيد أكسيد النيكل، والذي يستخدم باعتباره الكاثود في العديد من بطاريات قابلة لإعادة الشحن، بما في ذلك نيكل-كادميوم، حديد-نيكل، هيدروجين-نيكل، هيدريد معدن النيكل، وتستخدمه بعض الشركات المصنعة في بطاريات ليثيوم-أيون.[31]لا يزال Ni(IV) حالة أكسدة نادرة للنيكل ولا يُعرف سوى عدد قليل جداً من المركبات حتى الآن.[32][33][34][35]
التاريخ

نتيجة تشابه خام النيكل مع خام الفضة فكثيرا ما كان يتم الخطأ بينهما، ولذلك يرجع تاريخ استخدام النيكل وفصله إلى عصور قريبة. على الرغم من ذلك فقد أستخدم النيكل بطريقة غير مقصودة في العصور القديمة ويرجع تاريخ استخدامه إلى 3500 ق.م. فكان البرونز الذي يستخرج من سوريا -حاليا- يحتوي على 2% نيكل. فضلا عن ذلك فهناك أوراق صينية أقرت تأليف الصينيون النيكل ـ دون ان يكتشفوه ـ ما بين عامي 1700 و1400 ق.م. كمكون أساس لمادة " باي ثونگ " (Pai - Thung ) التي تعني النحاس الأبيض، والتي تتكون من 40 % نحاس، 32 % نيكل، 25 % زنك، 3 % حديد، وتشبه الفضة في شكلها. ومنذ ذلك الحين لم تظهر مادة (باي ـ ثنق ) في أوروبا الا في القرن السابع عشر وبنسب ضئيلة جدا ولكن محتويات السبيكة من النيكل لم تكتشف الا عام 1822.
في ألمانيا وجد خام أحمر في جبال الخام وتم تجميعها على أساس أنها خام النحاس وعندما لم يستطع خبراء التعدين الحصول على خام النحاس منها أعتقدوا أن هذا بسبب أشباح مؤذية من الأساطير الألمانية تمنع الخبراء من استخراج النحاس من هذا الخام وسموه "كوبفر نيكل" حيث تعني "كوبفر" النحاس وتعني نيكل شيطان. وسمي بعد ذلك هذا الخام باسم النيكلاين أو النيكولايت.
وقد كان هذا الإعتقاد سبباً في الإكتفاء بكلمة "نيكل" كإسم لهذا الفلز بواسطة العالم السويدي أكسل كرونستت الذي أفلح في استخلاص فلز النيكل ـ ولكن بصورة غير عالية النقاوة ـ من خام جرسدورفايت والتعرف عليه عام 1751، وفي عام 1775 تمكن بيرجمان من التعرف على النيكل كفلز منفصل يختلف عن النحاس. تلا ذلك عام 1804 استخلاص فلز النيكل بدرجة نقاوة عالية بواسطة الكيميائي ريتشر مما جعله يلم بتفاصيل أكثر عن صفاته الكيميائية، والفيزيائية ممهداً الطريق لوضع الفلز ضمن المجموعة الفرعية الثامنة من مجموعات العناصر الإنتقالية التي تقع بين المجموعتين الرئسيتين الثانية والثالثة من الجدول الدوري للعناصر، بعد الحديد والكوبلت، الذين يشبهانه في كثير من الصفات .
وقد ساعد التشابه الكبير بين الفضة وسبيكة النحاس ـ نيكل المعروفة بالنحاس الأبيض التي كان ينتجها الصينيون منذ العصور الوسطى في ازدهار تجارة النيكل، خاصة وان السبيكة المشار اليها اقل ثمناً من الفضة، حيث شهدت الفترة من 1830 إلى 1839 انتاج كميات تجارية من تلك السبيكة في ألمانيا وانجلترا، اطلق عليها الفضة الألمانية اولاً وفضة النيكل لاحقاً.
لا ذلك تطور هام في صناعة السبائك المحتوية على النيكل عندما اصدرت الولايات المتحدة الأمريكية عام 1851 عملة من سبيكة نحاسية تحتوي 12% نيكل، ثم تبعتها دول أخرى لتزدهر تجارة النيكل بشكل ملحوظ. أصدرت العملات الخالصة من النيكل أول مرة في عام 1881 في سويسرا.
بعد إكتشاف النيكل كعنصر جديد كان مصدر النيكل الوحيد هو الكوبفر نيكل النادر ولكن بعد عام 1824 تم الحصول على النيكل كنتيجة ثانوية من تصنيع الكوبالت الأزرق. كانت النرويج أكبر منتج للنيكل والتي استثمرته عام 1846.
دخل النيكل في صناعة الصلب عام 1889 وزاد الطلب على النيكل وزودت نيو كاليدونيا -تم اكتشاف النيكل بها عام 1865- العالم بالنيكل في الفترة بين 1875 و1915.
أكتشف المخزون الكبير من النيكل حول العالم في سادبوري في كندا عام 1883 ثم في نوريلسك-تالناخ في روسيا عام 1920 ثم في جنوب أفريقيا عام 1924 مما جعل انتاج كميات كبيرة من النيكل ممكنا.
الانتاج العالمي
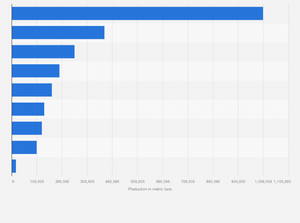
| الانتاج والودائع[37] | 2012 (طن متري) | 2011 (طن متري) | الودائع (طن متري) |
|---|---|---|---|
| أستراليا | 230,000 | 215,000 | 20,000,000 |
| بتسوانا | 26,000 | 26,000 | 490,000 |
| البرازيل | 140,000 | 209,000 | 7,500,000 |
| كندا | 220,000 | 220,000 | 3,300,000 |
| الصين | 91,000 | 89,800 | 3,000,000 |
| كولومبيا | 80,000 | 76,000 | 1,100,000 |
| كوبا | 72,000 | 71,000 | 5,500,000 |
| جمهورية الدومنيكان | 24,000 | 21,700 | 970,000 |
| إندونسيا | 320,000 | 290,000 | 3,900,000 |
| مدغشقر | 22,000 | 5,900 | 1,600,000 |
| كالدونيا الجديدة | 140,000 | 131,000 | 12,000,000 |
| الفلپين | 330,000 | 270,000 | 1,100,000 |
| روسيا | 270,000 | 267,000 | 6,100,000 |
| جنوب أفريقيا | 42,000 | 44,000 | 3,700,000 |
| بلدان أخرى | 120,000 | 103,000 | 4,600,000 |
| الإجمالي العالمي (بالطن المتري) | 2,100,000 | 1,940,000 | 75,000,000 |
| الدولة | قيم تصدير النيكل $ | النسبة المئوية من التصدير |
|---|---|---|
| إندونيسيا | 1.7 مليار دولار | 37.2% |
| زمبابوى | 737.1 مليون دولار | 16% |
| الفلپين | 600.4 مليون دولار | 13% |
| كاليدونيا الجديدة | 480.4 مليون | 10.4% |
| أستراليا | 307.5 مليون دولار | 6.7% |
| فنلندا | 241.7 مليون دولار | 5.2% |
| أمريكا | 177.7 مليون دولار | 3.8% |
| كندا | 163.1 مليون دولار | 3.5% |
| ساحل العاج | 120.3 مليون دولار | 2.6% |
| گواتيمالا | 23 مليون دولار | 0.5% |
| روسيا | 19.7 مليون دولار | 0.4% |
| زامبيا | 14.6 مليون دولار | 0.3% |
| ألبانيا | 6.9 مليون دولار | 0.2% |
| بلجيكا | 2.5 مليون دولار | 0.1% |
| ألمانيا | 2.3 مليون دولار | 0.05% |
وبهذه القيمة تكون الدول 15 قد شحنت 99.8% من النيكل المُصدَّر في العالم لعام 2020.
أزمة 2022
في 8 مارس 2022، أُجبرت بورصة لندن للمعادن على وقف تداول النيكل وإلغاء التداولات بعد أن تضاعفت الأسعار لأكثر من 100.000 دولار للطن (بزيادة 600%) التي قيل أنها بسبب التغطية قصيرة الأجل من جانب روسيا، التي تعتبر من أكبر منتجي النيكل في العالم. جاءت الخطوة المفاجئة لبورصة لندن للمعادن في الوقت الذي هددت فيه العقوبات الغربية الإمدادات من روسيا، وكانت أكبر أزمة تضرب البورصة البالغة من العمر 145 عامًا منذ عقود.[38]
في التسعينيات، حاول تاجر مارق من شركة سوميتومو السيطرة على سوق النحاس وتوقف تداول القصدير لخمس سنوات في الثمانينيات.
وقالت البورصة في إشعار للأعضاء: "الأحداث الحالية غير مسبوقة". "لقد خلق تعليق سوق النيكل عددًا من القضايا للمشاركين في السوق والتي تحتاج إلى معالجة." وسط ذعر السوق الذي أشعله الغزو الروسي لأوكرانيا، يتدافع المشترون للحصول على المعدن الضروري لصنع الفولاذ المقاوم للصدأ وبطاريات السيارات الكهربائية. قال التجار إن بعض أصحاب المراكز يكافحون أيضًا لدفع متطلبات الربح.
قالت ثلاثة مصادر مطلعة إن مجموعة تسينگشان القابضة الصينية، أحد أكبر منتجي النيكل والفولاذ المقاوم للصدأ في العالم، كانت تؤسس لنفسها مركزًا صغيراً لإنتاج النيكل منذ عام 2021، وتراهن على انخفاض الأسعار. وقالت المجموعة إن الأسعار قفزت بشدة حيث اشترت تسينگشان كميات كبيرة من النيكل لتقليل تلك الرهانات القصيرة وتعرضها لطلبات الربح المكلفة. رفضت بورصة لندن للمعادن ومجموعة تسينگشان التعليق لرويترز.
رفعت بورصة لندن للمعادن متطلبات الربح لعقود النيكل بنسبة 12.5% إلى 2250 دولارًا للطن وأوقفت تداول النيكل في جميع الأماكن لبقية اليوم على الأقل. أعلنت بورصة لندن للمعادن أنه سيتم إلغاء جميع التداولات من منتصف الليل حتى الساعة 8:15 صباحًا يوم الثلاثاء 8 مارس وقت توقف التداول وأضافت أنها تدرس الإغلاق لعدة أيام.
وقال كولين هاميلتون، العضو المنتدب لأبحاث السلع في BMO لأسواق رأس المال: "سيتساءل الناس عما إذا كان هذا سوقًا فعالاً حقًا... هذا يعني أن يكون سوق الملاذ الأخير ولا يمكن للناس الحصول على مخزونات لتسليمها مقابل المراكز".
كما أرجأت بورصة لندن للمعادن التسليم الفعلي للعقود المستحقة وأعلنت أنها ستتوقف مؤقتًا عن نشر أسعار النيكل الرسمية وإغلاقها. ستخطط بورصة لندن للمعادن بنشاط لإعادة فتح سوق النيكل، وستعلن عن آليات ذلك في السوق في أقرب وقت ممكن."
ارتفع سعر النيكل لثلاثة أشهر في بورصة لندن للمعادن بأكثر من الضعف إلى 101.365 دولارًا للطن قبل أن توقف بورصة لندن للمعادن تداوله على أنظمتها الإلكترونية. قلص النيكل مكاسبه إلى 80 ألف دولار للطن عند توقف التداول، بارتفاع 66% خلال 8 مارس و177٪ منذ اليوم السابق. في الصين، رفعت بورصة شنغهاي للعقود الآجلة رسوم تداول النيكل وحثت المستثمرين على "تجنب المخاطر والاستثمار بعقلانية والعمل معًا للحفاظ على استقرار السوق".
وصل النيكل في بورصة شنغهاي إلى حده الصعودي في التداول الليلي عند مستوى قياسي بلغ 267.700 يوان (42380.39 دولارًا أمريكيًا) للطن، ووصل أيضًا إلى حد 15٪ في وقت مبكر يوم 8 مارس. حذرت CITIC Futures، أكبر شركة عقود آجلة في الصين، العملاء من أنه إذا استمرت أسعار النيكل في الارتفاع يوم الأربعاء 9 مارس، فقد تتخذ بورصة شنغهاي إجراءات، بما في ذلك تخفيضات قسرية في المراكز، حسبما أظهر إشعار داخلي اطلعت عليه رويترز.
في 14 مارس 2022، أجرت مجموعة بنوك بقيادة جي پي مورگان تشيس وشركاه محادثات متقدمة للحصول على تسهيل قرض لدعم مركز مجموعة تسينگشان الصينية في النيكل، في محاولة لاستعادة الاستقرار في السوق بعد ضغوط غير مسبوقة. ستسمح الصفقة لتسينگشان بالاحتفاظ بمركزها القصير، الذي أزعج سوق النيكل بعد أن كافحت لدفع طلبات الربح الضخمة للبنوك والوسطاء الأسبوع الماضي. إذا ما تمت الصفقة، فقد يمنح القرض بورصة لندن للمعادن اليقين الذي تحتاجه لإعادة فتح سوق النيكل، الذي تم تعليقه منذ صباح الثلاثاء 8 مارس. [39]
بموجب الصفقة التي تجري مناقشتها، فإن البنوك العشرة التي كانت نظراء مجموعة تسينگشان مقابل رهانها على النيكل ستمنح ائتمانًا كافيًا لتغطية خسائرها في السوق، وفقًا لأشخاص مطلعين على الأمر. بشكل حاسم، ستوفر الصفقة أيضًا تسهيلات قرض للسماح لمجموعة تسينگشان بتلبية طلبات الربح المستقبلية في حالة زيادة سعر النيكل بشكل أكبر. في المقابل، تقدم مجموعة تسينگشان للبنوك التأمين من خلال مجموعة واسعة من الأصول التي تمتلكها الشركة.
الاستخراج والتنقية


يعتبر البنتلانديت، وهو مزيج من الكبريت والحديد والنيكل، المصدر الرئيسي لفلز النيكل. وهناك مصادر أخرى هي الميلريت والنيكوليت.
وتُعتبر روسيا، وكندا، ونيوكاليدونيا، وأستراليا، وإندونيسيا، من الدول الرائدة في إنتاج النيكل.
التطبيقات


يُستخدم النيكل في الأعمال الهيكلية والتغطية الكهربائية لمقاومته الصدأ. وتستخدم المطابع كثيراً ألواح طباعة مغطاة بالنيكل لتستطيع احتمال الاستعمال الشديد. انظر: الطلاء بالكهرباء. ويكوِّن بيروكسيد النيكل مادة موجبة فعالة في مركم أديسون (البطارية المشحونة)، كما يستعمل النيكل في مركم الكادميوم والنيكل. انظر: البطارية.
ومن استخدامات النيكل الهامة تنشيط تفاعلات كيميائية معينة بطريقة الحفز. انظر: الحفز. ولا يتغير النيكل نفسه خلال هذه العملية ويمكن تكرار استعماله. ويستخدم النيكل حفازًا في عملية تسمى الهدرجة إذ يساعد النيكل بعض المكونات العضوية على الاتحاد مع الهيدروجين لتكوين مكونات جديدة. وتُنتج الهدرجة زيتًا نباتيًا جامدًا للطهي. انظر: الهدرجة.
سبائك النيكل-الحديد
ربما كان أكبر استعمال للنيكل هو إضافته للحديد والصلب. فهو يحسِّن هذه الفلزات من عدة وجوه ويجعل الحديد أكثر ليونة (سهل التشكيل). ويستخدم المصنعون سبائك الصلب والنيكل كثيرًا في صناعة الألواح المصفحة وأجزاء الآلات.
الإنفار
سبيكة من النيكل والحديد وفلزات أخرى، ويُستخدم في قياس الأشرطة والبندولات. وهو قليل التمدد والتقلص أثناء تغير درجة حرارته.
معدن مونيل
سبيكة من النيكل والنحاس تُستعمل في صنع الرقائق الفلزية. ولها مقاومة عالية جداً للصدأ. انظر: معدن مونيل.
فضة النيكل. وتُسمى أيضاً الفضة الألمانية، وهي سبيكة من النيكل تستعمل في صنع أدوات المائدة.
الدور الحيوي
يعتبر معدن النيكل العنصر الثاني والعشرين من حيث الوفرة في القشرة الأرضية، كما يعد المعدن السابع بالنسبة لوفرة العناصر الانتقالية، وعلى الرغم من وجود كثير من المعادن التي تحتوي على عنصر النيكل، إلا أن معادن الكبريتيد والأكاسيد تعد أهم المعادن الرئيسية لإنتاجه.
الجدير بالذكر أن معدن النيكل يستخدم بشكل رئيسي في صناعة السبائك المختلفة حيث يمكن خلطه مع كثير من الفلزات مثل النحاس، والمنجنيز، والحديد، والكروم، ويستخدم خاصة في السبائك غير الحديدية والصلب لتحسين جودتها من حيث المتانة، ومقاومة التآكل، والصلادة وخصائصه الجيدة عند درجات الحرارة العالية
يمكن للنيكل أن يدخل الجسم عن طريق تناول الطعام، أو شرب المياه أو استنشاق الهواء. ويعد الامتصاص المعوي المعدي من الغذاء أو الماء المصدر الأساسي للنيكل المترسب داخلياً بين عموم السكان. ويتم امتصاص حوالي 5% من الكمية المبتلعة إلى مجرى الدم عبر الأمعاء, بينما يمكن امتصاص ما نسبته تتراوح بين 20-35% عن طريق الرئتين. ويتم التخلص سريعاً مما نسبته 68% من النيكل الذي يصل إلى الدم وذلك في البول، بينما يتبقى 2% منه في الكليتين حيث يكون عمر النصف البيولوجي له قصيراً جداً ويساوي 0.2 من اليوم (أي حوالي 5 ساعات). أما ال 30% المتبقية فهي تتوزع في بقية أنسجة الجسم, بما في ذلك الكليتين، وتتم تصفيتها بعمر نصف بيولوجي يساوي 1200 يوم. (هذه المعلومة تخصُ موديلات مبسَّطة لا تعكس إعادة توزيع انتقالية).
يُشتبَه أن النيكل المنبعث من ثورات براكين مصاطب سيبيريا ساعد على نمو Methanosarcina، الذي هو جنس من عتائق euryarchaeote التي أنتجت ميثان أثناء الانقراض الجماعي الپرمي-الثلاثي، أكبر حدث انقراض مسجل.[40]
السمية
| المخاطر | |
|---|---|
| ن.م.ع. مخطط تصويري |   
|
| ن.م.ع. كلمة الاشارة | Danger |
| H317, H351, H372, H412 | |
| P201, P202, P260, P264, P270, P272, P273, P280, P302+P352, P308+P313, P333+P313, P363, P405, P501[41] | |
| NFPA 704 (معيـَّن النار) | |
يعد النيكل خطراً على الصحة فقط في حال دخوله إلى الجسم. ولا يعد التعرض الخارجي لأشعة گاما أمراً مقلقاً وذلك لكون نظيري النيكل هذين لا يصدران أشعة غاما بكمية مهمة. إذ أن النيكل-63 يضمحل عن طريق إصداره جسيم بيتا كما أن النيكل-59 يضمحل عن طريق أسر إلكترون، يتم فيه إصدار أشعة غاما منخفضة الطاقة. أما في الجسم, فإن النيكل يمثل خطراً صحياً بسبب جسيمات بيتا وأشعة غاما؛ ويرتبط القلق الصحي الأساسي بالاحتمال المتزايد للتسبب بنشوء السرطان.
المركز الدولي لبحوث السرطان circ يصنف النيكل من المواد المسببة لسرطان عند الإنسان، التعرض المزمن للنيكل هو أحد عوامل الخطر للاصابة بـ سرطان الرئة.
النيكل هو أكثر المعادن المسببة للحساسية (12% من السكان مصابون بالحساسية نتيجة استخدامهم المفرط للنيكل حيث تصاب غالبية النساء بالاكزيما نتيجة استعمالهم للمجوهرات والاكسسوارات التي تحتوي على النيكل. ولهذا السبب تم استبعاده لسبائك النيكل المستخدمة للعملات الاوروبية الجديدة.[42]
يوجد النيكل في البيئة بمعدلات قليلة. يستخدم الإنسان معدن النيكل في تطبيقات متعددة، ومن أشهر هذه التطبيقات يستخدم كمكون لمنتجات الصلب والمعادن الأخرى كما نجده في المجوهرات. تحتوى المواد الغذائية على نسب ضئيلة منهن أما من المعروف عن الشيكولاته والدهون أنها تحتوى على كميات عالية من معدن النيكل. تزيد معدلات استهلاكه عند تناول كميات كبيرة من الخضراوات مزروعة في تربة ملوثة به. يتواجد النيكل في المنظفات. المدخن للسجائر يتعرض لتخلل معدن النيكل إلى الرئة. يتعرض الإنسان العادى للنيكل بتنفسه من الهواء وبشربه من مياه الشرب، وتناول الأطعمة أو تدخين السجائر. كما ياتى التعرض بالتلامس الجلدى لتربة أو ماء ملوثتين بهذا المعدن.
تناول الكميات الصغيرة منه ضرورية، أما الكثير منه يعرض الإنسان لمخاطر صحية مثل:
- زيادة مخاطر التعرض لـ: سرطان الرئة، سرطان الأنف، سرطان
الحنجرة، سرطان البروستاتة * الشعور بالدوار والإعياء بعد التعرض لغازات النيكل.
- الإصابة بالصمامة الرئوية.
- فشل الجهاز التنفسى.
- التشوهات الخلقية للجنين.
- أزمة الربو، التهاب الشعب الهوائية.
- اضطرابات في القلب.
- ردود فعل من الحساسية مثل الطفح الجلدى وخاصة عند ارتداء المجوهرات.
- أدخنة النيكل من مثيرات الجهاز التنفسى وقد تسبب الالتهاب الرئوى.
- التعرض للنيكل ومركباته قد ينتج عنها التهاب طبقة الجلد الخارجية والمعروف عنها باسم (هرش النيكل - Nickel Itch) للأشخاص الذى يكون جلدها حساس أو لديها حساسية من النيكل.
تم تصنيف النيكل طبقاً للوكالة الدولية لأبحاث السرطان في مجموعتين:
- المجموعة (أ): مركبات النيكل مسببة للسرطان في الإنسان، وهناك أدلة كافية تثبت ذلك.
- المجموعة (ب): تصنف النيكل نفسه بأنه إحدى العوامل المحتمل أن تساهم في إصابة الإنسان بالسرطان.
معاملات الخطورة الإشعاعية
يوضح هذا الجدول بعض القيم لمعاملات الخطورة بالنسبة للاستنشاق والابتلاع. تم استخدام أنماط امتصاص افتراضية موصى بالنسبة للاستنشاق، وتم كذلك استخدام قيم غذائية بالنسبة للابتلاع. وقد أخذت قيم الخطورة بالنسبة للوفاة بالسرطان وفقاً للعمر لكل وحدة إدخال، بأخذ معدلها بالنسبة لجميع الأعمار ولكلا الجنسين. (تساوي جزءاً من تريليون جزء). وتتاح أيضاً قيم أخرى، بما في ذلك ما يخص الوفيات.
ونظائر النيكل الأكثر خطورة هي نيكل-59 ونيكل-63.
لقد تم حساب معاملات خطورة الوفاة بالسرطان حسب الفئة العمرية فيما يخص جميع النكليدات المشعة، بما في ذلك النيكل. وبينما تبدو المعاملات بالنسبة للابتلاع منخفضة نوعاً ما بالمقارنة مع ما يقابلها بالنسبة للاستنشاق، فإن الابتلاع بشكل عام يشكل أكثر الوسائل شيوعاً كطريقة للدخول إلى الجسم. وعلى غرار بقية النكليدات المشعة، تعادل معاملات الخطورة فيما يخصُّمياه الصنبور ما نسبته حوالي 70% مقارنة بما يقابلها في حالة الابتلاع الغذائي.
وبالإضافة إلى الآثار الإشعاعية المحتملة، فقد تبيَّن أنّ النيكل يسبب نقصاناً في وزن الأعضاء ووزن الجسم لتقديرالتأثيرات لدى الحيوانات, وبخاصّة عند الجرعات الكبيرة. ويطلق على قيمة السمية.(وهي تقييم قيمة)لأعلى غير السرطانية المحتملة مصطلح هو الجرعة المرجعية جرعة يستطاع تناولها يومياً دون التسبب بأثر مضاد.
انظر أيضاً
المصادر
- ^ Carnes, M.; et al. (2009). "A Stable Tetraalkyl Complex of Nickel(IV)". Angewandte Chemie International Edition. 48: 3384. doi:10.1002/anie.200804435.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ^ Pfirrmann, S.; et al. (2009). "A Dinuclear Nickel(I) Dinitrogen Complex and its Reduction in Single-Electron Steps". Angewandte Chemie International Edition. 48: 3357. doi:10.1002/anie.200805862.
{{cite journal}}: Explicit use of et al. in:|author=(help) - ^ Anthony, John W.; Bideaux, Richard A.; Bladh, Kenneth W.; Nichols, Monte C., eds. (1990). "Nickel" (PDF). Handbook of Mineralogy. Vol. I. Chantilly, VA, US: Mineralogical Society of America. ISBN 978-0962209703.
- ^ "Nickel: Nickel mineral information and data". Mindat.org. Archived from the original on March 3, 2016. Retrieved 2016-03-02.
- ^ Stixrude, Lars; Waserman, Evgeny; Cohen, Ronald (November 1997). "Composition and temperature of Earth's inner core". Journal of Geophysical Research. 102 (B11): 24729–24740. Bibcode:1997JGR...10224729S. doi:10.1029/97JB02125.
- ^ Coey, J. M. D.; Skumryev, V.; Gallagher, K. (1999). "Rare-earth metals: Is gadolinium really ferromagnetic?". Nature. 401 (6748): 35–36. Bibcode:1999Natur.401...35C. doi:10.1038/43363. S2CID 4383791.
- ^ "Nickel Use In Society". Nickel Institute. Archived from the original on September 21, 2017.
- ^ Treadgold, Tim. "Gold Is Hot But Nickel Is Hotter As Demand Grows For Batteries In Electric Vehicles". Forbes (in الإنجليزية). Retrieved 2020-10-14.
- ^ "Nickel Compounds – The Inside Story". Nickel Institute. Archived from the original on 2018-08-31.
- ^ Mulrooney, Scott B.; Hausinger, Robert P. (2003-06-01). "Nickel uptake and utilization by microorganisms". FEMS Microbiology Reviews (in الإنجليزية). 27 (2–3): 239–261. doi:10.1016/S0168-6445(03)00042-1. ISSN 0168-6445. PMID 12829270.
- ^ أ ب Scerri, Eric R. (2007). The periodic table: its story and its significance. Oxford University Press. pp. 239–240. ISBN 978-0-19-530573-9.
- ^ Miessler, G.L. and Tarr, D.A. (1999) Inorganic Chemistry 2nd ed., Prentice–Hall. p. 38. ISBN 0138418918.
- ^ Petrucci, R.H. et al. (2002) General Chemistry 8th ed., Prentice–Hall. p. 950. ISBN 0130143294.
- ^ أ ب NIST Atomic Spectrum Database Archived مارس 20, 2011 at the Wayback Machine To read the nickel atom levels, type "Ni I" in the Spectrum box and click on Retrieve data.
- ^ Shurtleff, Richard; Derringh, Edward (1989). "The Most Tightly Bound Nuclei". American Journal of Physics. 57 (6): 552. Bibcode:1989AmJPh..57..552S. doi:10.1119/1.15970. Archived from the original on May 14, 2011. Retrieved November 19, 2008.
- ^ "Nuclear synthesis". hyperphysics.phy-astr.gsu.edu. Retrieved 2020-10-15.
- ^ أ ب Fewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy". American Journal of Physics. 63 (7): 653. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ^ أ ب Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A 729: 3–128, doi:, Bibcode: 2003NuPhA.729....3A, https://hal.archives-ouvertes.fr/in2p3-00020241/document
- ^ Pagel, Bernard Ephraim Julius (1997). "Further burning stages: evolution of massive stars". Nucleosynthesis and chemical evolution of galaxies. pp. 154–160. ISBN 978-0-521-55958-4.
- ^ Castelvecchi, Davide (April 22, 2005). "Atom Smashers Shed Light on Supernovae, Big Bang". Archived from the original on July 23, 2012. Retrieved November 19, 2008.
- ^ W, P. (October 23, 1999). "Twice-magic metal makes its debut – isotope of nickel". Science News. Archived from the original on May 24, 2012. Retrieved September 29, 2006.
- ^ Carboneau, M. L.; Adams, J. P. (1995). "Nickel-63". National Low-Level Waste Management Program Radionuclide Report Series. 10. doi:10.2172/31669.
- ^ غدير زيزفون. "النيكل". الموسوعة العربية. Retrieved 2014-10-149.
{{cite web}}: Check date values in:|accessdate=(help) - ^ "The Extraction of Nickel from its Ores by the Mond Process". Nature. 59 (1516): 63–64. 1898. Bibcode:1898Natur..59...63.. doi:10.1038/059063a0.
- ^ أ ب ت قالب:Housecroft3rd
- ^ قالب:Housecroft4th
- ^ Lascelles, Keith; Morgan, Lindsay G.; Nicholls, David and Beyersmann, Detmar (2005) "Nickel Compounds" in Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim. doi:10.1002/14356007.a17_235.pub2
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةGreenwood - ^ Jensen, K. A. (1936). "Zur Stereochemie des koordinativ vierwertigen Nickels". Zeitschrift für Anorganische und Allgemeine Chemie. 229 (3): 265–281. doi:10.1002/zaac.19362290304.
- ^ Court, T. L.; Dove, M. F. A. (1973). "Fluorine compounds of nickel(III)". Journal of the Chemical Society, Dalton Transactions (19): 1995. doi:10.1039/DT9730001995.
- ^ "Imara Corporation Launches; New Li-ion Battery Technology for High-Power Applications". Green Car Congress. December 18, 2008. Archived from the original on December 22, 2008. Retrieved January 22, 2009.
- ^ Spokoyny, Alexander M.; Li, Tina C.; Farha, Omar K.; Machan, Charles M.; She, Chunxing; Stern, Charlotte L.; Marks, Tobin J.; Hupp, Joseph T.; Mirkin, Chad A. (28 June 2010). "Electronic Tuning of Nickel-Based Bis(dicarbollide) Redox Shuttles in Dye-Sensitized Solar Cells". Angew. Chem. Int. Ed. 49 (31): 5339–5343. doi:10.1002/anie.201002181. PMID 20586090.
- ^ Hawthorne, M. Frederick (1967). "(3)-1,2-Dicarbollyl Complexes of Nickel(III) and Nickel(IV)". Journal of the American Chemical Society. 89 (2): 470–471. doi:10.1021/ja00978a065.
- ^ Camasso, N. M.; Sanford, M. S. (2015). "Design, synthesis, and carbon-heteroatom coupling reactions of organometallic nickel(IV) complexes". Science. 347 (6227): 1218–20. Bibcode:2015Sci...347.1218C. CiteSeerX 10.1.1.897.9273. doi:10.1126/science.aaa4526. PMID 25766226. S2CID 206634533.
- ^ Baucom, E. I.; Drago, R. S. (1971). "Nickel(II) and nickel(IV) complexes of 2,6-diacetylpyridine dioxime". Journal of the American Chemical Society. 93 (24): 6469–6475. doi:10.1021/ja00753a022.
- ^ M. Garside (2022-03-08). "Major countries in worldwide nickel mine production in 2021". www.statista.com.
- ^ "Nickel" (PDF). U.S. Geological Survey, Mineral Commodity Summaries. January 2013.
- ^ "LME forced to halt nickel trading, cancel deals, after prices top $100,000". رويترز. 2022-03-08. Retrieved 2022-03-14.
- ^ "Nickel Tycoon Closes In on JPMorgan-Led Loan to Backstop Short". finance.yahoo.com. 2022-03-14. Retrieved 2022-03-14.
- ^
Schirber, Michael (July 27, 2014). "Microbe's Innovation May Have Started Largest Extinction Event on Earth". Space.com. Astrobiology Magazine. Archived from the original on July 29, 2014. Retrieved July 29, 2014.
.... That spike in nickel allowed methanogens to take off.
- ^ "Nickel 203904". Sigma Aldrich. Archived from the original on January 26, 2020. Retrieved January 26, 2020.
- ^ المعادن الثقيلة.. سموم بيئية، فيدو
قراءات إضافية
- محمد عز الدهشان، الفلزات غير الحديدية وسبائكها (جامعة الملك سعود- النشر العلمي والمطابع، الرياض 1418هـ/1990م).
- هنري دكر وهيام بيرقدار، الكيمياء اللاعضوية الجزء الثاني (مطبعة محمد هاشم الكتبي، 1391هـ/1971م).
- W.LATIMER and J.HILDBRAND,Reference Book of Inorganic Chemistry (The Macmillan Company 1959).
وصلات خارجية
- Nickel at The Periodic Table of Videos (University of Nottingham)
- CDC – Nickel – NIOSH Workplace Safety and Health Topic
- An occupational hygiene assessment of dermal nickel exposures in primary production industries by GW Hughson. Institute of Occupational Medicine Research Report TM/04/05
- An occupational hygiene assessment of dermal nickel exposures in primary production and primary user industries. Phase 2 Report by GW Hughson. Institute of Occupational Medicine Research Report TM/05/06
- Norilsk Nickel, Norilsk, Russia
- Vale Nickel, Sudbury, Ontario, Canada (formerly known as INCO)
| أظهر الجدول الدوري |
|---|
- Short description is different from Wikidata
- Pages using infobox element with unknown parameters
- Articles with unsourced statements from January 2021
- Articles with unsourced statements from October 2020
- Articles with hatnote templates targeting a nonexistent page
- GHS warnings
- Chembox container only
- مركبات النيكل
- نيكل
- أحياء وصيدلة العناصر الكيميائية
- عناصر كيميائية
- معادن غذائية
- مواد حديدية المغناطيسية
- مسرطنات المجموعة 2 بي حسب تصنيف الوكالة الدولية لأبحاث السرطان
- فلزات انتقالية