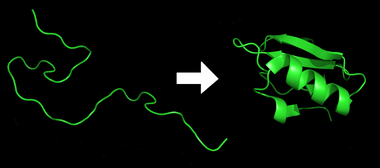
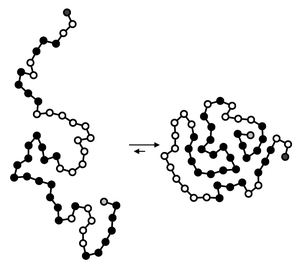
طي الپروتين
طي البروتين Protein folding هي عملية طبيعية فإن البروتين، بعد التخليق بواسطة ريبوسوم كسلسلة خطية من أحماض أمينية، يتغير من ملف عشوائي غير مستقر إلى بُنية ثلاثية الأبعاد أكثر تنظيماً. هذه البنية تسمح للبروتين أن يصبح فعال حيوياً.[1]
تبدأ الحياة لآلاف البروتينات ـ التي تقوم بوظائف حيوية داخل أجسامنا ـ بتحد. إذ يتعين على البروتين أن يحوّل نفسه، من سلسلة طويلة مرنة وناعمة من الأحماض الأمينية، إلى جزء له شكل محدد، وبه مختلف الالتواءات والانحناءات التي تلزمه لأداء وظيفته في الخلية، وهي ما يطلق عليه (طيّ البروتين) Protein Folding.
إن فهم عملية طيّ البروتين بالغة الأهمية لإنتاج المستحضرات الصيدلية البروتينية. كما تؤدي هذه العملية دوراً جوهرياً في التفاعلات الحيوية التي تحدث داخل الخلية. ومع نمو وازدهار صناعات التكنولوجيا الحيوية، زاد بدرجة كبيرة الاهتمام بطيّ البروتين، إذ عادة ما يحتاج تطوير عمليات الإنتاج التجاري للبروتينات المصنّعة، إلى طريقة فعالة وعالية الإنتاجية لطيّ البروتين.
ويعد طي البروتين أحد أعاجيب الطبيعة. وعندما تنزاح البروتينات بعيداً عن خطوط تجمع الخلايا، فإنها تصبح لا شيء أكثر من سلاسل طويلة من الأحماض الأمينية. ويوجد عشرون نوعاً من الأحماض الأمينية، ويحتوي البروتين عادة ما بين مائة إلى عشرة آلاف حمض أميني. وتؤدي هذه الأحماض الأمينية وظيفة مهمة، إذ إنها تجسد شكل ووظيفة البروتين.
ونحن نعرف أن هناك ثمانية وعشرين حرفاً في اللغة العربية، يمكن ترتيبها بحيث تعطي مجموعة من الكلمات ذات معنى، وكذلك فإن الأحماض الأمينية تتجمع مع بعضها البعض، لتكوين عشرات الملايين من البروتينات، في كل الكائنات الحيّة التي تعيش فوق كوكب الأرض.
الزمامات البيولوجية المنزلقة
وينفذ البروتين مهامه من خلال التعاون البيولوجي، حيث يرتبط بروتينان كل منهما بالآخر للعمل ككيان وظيفي واحد. وبعد تجميع قواهما، (يعصر) هذان الشريكان بينهما الحمض النووي (دنا)، كالمصارع الذي يسيطر على خصمه بمسكة (المقص) بواسطة القدمين!
والمعتقد أن هذين البروتينين يرتبط كل منهما بالآخر بأحماض أمينية تسمى (لوسينات) Leucines، حيث تشكل اللوسينات حافة خشنة من العُقد، بامتداد أحد جانبي كل بروتين. وعندما يتلامس البروتينان، تتداخل اللوسينات وتندس عُقد أحد البروتينين بين عُقد البروتين الثاني، تماماً مثل أسنان الزمام المنزلق للملابس Zipper. وعندئذ يتشابك البروتينان معا بقوة، وتصبح بمنزلة زمام بيولوجي منزلق.
اللغز والطيّات العديدة
تصور خيطاً من حبات ملونة كبيرة، صفراء وخضراء وحمراء وزرقاء وبنية. علماً بأن الحبات الصفراء تنجذب إلى بعضها البعض مثل المغناطيسات. وتتنافر الحبات الخضراء مع مثيلاتها، وتنجذب الحبات الحمراء بقوة ضعيفة إلى الحبات الزرقاء، ما لم توجد بجوارها حبة بنية اللون. وتذكر أيضا أن الحبات الحمراء تفضل أن تستقر بين الحبات الصفراء، ما لم توجد حبات خضراء بينها! والآن كوّن تسلسلاً عشوائياً من بضع مئات من الحبات الملونة المختلفة ـ التي تمثل الأحماض الأمينية ـ وتنبأ بالتركيب ثلاثي الأبعاد، الذي سوف ينطوي الخيط ذاتيا إليه!
يبدو الأمر غاية في التعقيد. ولكن علماء البيولوجيا يمارسون هذه (اللعبة)، ويطلقون عليها (لغز طي البروتين).
ولكل بروتين تسلسل للأحماض الأمينية خاص به فقط، وينتهي بطريقة ما، بالطيّة المميزة له. لكن مثل هذه السلسلة المعقدة يمكن أن تنطوي بعدد كبير جداً من الطرق المختلفة، ومن ثم كيف يتأتى للبروتين أن ينتهي بالشكل الصحيح له بالضبط? لا يمكن الإجابة عن هذا السؤال بالتخمين أو باتباع طريقة التجربة والخطأ. إن عمر الكون نفسه يعد قصيراً مقارنة بالوقت الذي يستغرقه بروتين صغير لتجربة بلايين من الطيّات الممكنة واحدة وراء أخرى، وصولاً إلى الطيّة الصحيحة!
إذ إن البروتينات تنثني وتلتوي وتلتف في شكل حلقات أو حلزونات، بينما تنضغط بعض البروتينات الأخرى في رقائق مطويّة تشبه الآلة الموسيقية (الأكورديون)، وكذلك في أشكال أخرى.
وهذه الطيّات تساعد على أداء البروتينات لوظائفها الجوهرية داخل الخلايا.
فعلى سبيل المثال، فإن الزوايا والشقوق في طيات أي إنزيم هضم ـ وهو أحد البروتينات ـ يمكنها أن تحتجز جزيئات النشا ثم تقترب بعد ذلك الكيماويات التي تحللها إلى سكر. وبالمثل، تكمن البكتريا والفيروسات بقوة في ثنايا وطيّات الأجسام المضادة، التي تمسكها بإحكام.، بينما تطلب (النجدة) من آليات الدفاع الأخرى بجهاز المناعة في الجسم.
وعندما تواصل سلسلة الأحماض الأمينية المفتوحة، عملية الوصول إلى الشكل النهائي للطيّة، فإنها تواجه الكثير من التطورات غير المرغوب فيها. فالأحماض الأمينية تتنافر وتتجاذب فيما بينها، كما أنها تتفاعل مع جزيئات أخرى في الجسم، من أجل إتمام بعض الاتصالات الكيميائية الحيوية.
ترى ما السر الذي يكمن وراء لغز طيّ البروتين? إن الإجابة عن هذا التساؤل، أصبحت واحدة من أكثر مناطق الكيمياء الحيوية إثارة، لأن البروتينات ـ على هيئة أنزيمات وهرمونات وأجسام مضادة... إلخ ـ تقوم بوظائف بيولوجية بالغة الأهمية للجسم.
والواقع أن عملية طي البروتينات بطريقة صحيحة، وبقاءها مطوية خارج بيئتها الخلوية الطبيعية، هي واحدة من أكثر المشاكل المحبطة للآمال في صناعة التقانة الحيوية. إذ ربما يُدخل الباحثون جينا Gene لبروتين بشري مهم ونادر، في بكتريا وينجحون في الحصول على كميات كبيرة من هذا البروتين ـ باستخدام الهندسة الوراثية ـ ثم يكتشفون في النهاية أن جزيئاته لا تنطوي داخل خلايا البكتريا، أو أنها تلتصق ببعضها البعض، في تكتلات لا قيمة لها. وأحياناً ينتجون ما يبدو أنه بروتين مطويّ بطريقة صحيحة، ثم يفاجأون برؤيته ينحل عند إخراج العينات من حجرة التجميد ـ حيث تجرى التجـارب ـ لإذابتها.
وأي شخص يتعامل مع البروتينات غير المطوية في أنبوب اختبار، هو فقط الذي يعرف جيداً المخاطر المحتملة، فبدلاً من أن تنتهي التجربة، بجزيئات البروتين وهي تعمل بنشاط كامل، ربما يحصل الباحث على كتلة هلامية متداخلة في بعضها البعض، تعد المُناظر الكيميائي لطبق من المكرونة (الإسباجتي)، التي تركت على النار أكثر من اللازم، فتعجنت!
تصميم البروتينات
ويكمن جزء من التحدي الكامن في لغز طي البروتين، في أنه لا يظل متجمداً في شكل ثابت واحد، وحتى عندما يكون مستقراً في محلول ما، فإنه يتأرجح بسرعة بين أشكال مختلفة. وعندما تتلاصق البروتينات مع جزيئات مجاورة، فإننا نتوقع حدوث أي عدد من التغيرات لها.
والمشكلة الحقيقية في طي البروتين، هي في التعامل مع حالات تتحول بسرعة فائقة، ربما تصل إلى جزء من الثانية! وهذه التحولات تجعل من الصعب القياس التجريبي للتركيب (المثالي) للبروتينات البسيطة، الذي يفضل العلماء معرفة بعض القواعد الأساسية لعملية طيّها.
ويؤثر تسلسل الأحماض الأمينية في التركيب ثلاثي الأبعاد للبروتين، ويهدف العلماء إلى معرفة كيفية تغير تركيب البروتين وبالتالي وظيفته. ومن خلال استبدال حمض أميني معين به، يستطيعون (تصميم) بروتينات مصنّعة جديدة تماماً، يمكنها تأدية وظائف حيوية محددة.
بيد أن الأمر يحتاج في المختبر إلى سنوات، لتحديد التركيب ثلاثي الأبعاد للبروتين، باستخدام الأشعة السينية (أشعة إكس) أو التصوير بالرنين المغناطيسي النووي Nuclear Magnetic Resonance. وهما الطريقتان اللتان يعوّل عليهما حالياً، لمسح التضاريس السطحية للبروتينات. وفي الوقت نفسه، يتم تحديد تسلسلات الأحماض الأمينية كل يوم، مما يؤدي إلى وجود عدد كبير ومتزايد من البروتينات معروفة التسلسل، ولكن تركيبها الدقيق الداخلي، لا يزال مجهولاً!
والخلاصة، أن على علماء البيولوجيا التنبؤ من تسلسل الحـــموض الأمينية للبروتين، بكيفية حدوث عملية طي البروتين. لكن ترى ما هي أنواع البروتينات التي قد يرغب العلماء في إعادة تصميمها? إن القائمة تتزايد بسرعة، إذ يتعاظم ترسيخ فكرة أن البروتينات نوع رئيسي من الكيماويات المنظمة في الجسم، وإنها تؤثر في عدد كبير من الوظائف الحيوية التي تتراوح ما بين المــــنـاعة إلى الحالة النفسية للإنسان.
البريونات وتدمير الخلية
إن اكتشاف آلية طي البروتينات وتداعياتها المستقبلية، بالغ الأهمية لعلاج الأمراض الناجمة عن الخلل في عملية الطي، وهي تتعلق بالتغير الذي يحدث للبروتين من خيط أصلي لا شكل له من الأحماض الأمينية، إلى كيان مطوي ثلاثي الأبعاد.
وقد أثمرت الأبحاث العلمية الحديثة، الكشف عن بعض الحقائق الخاصة بكيفية حدوث هذا التحوّل، وتصحيح عدد من الأفكار الخاطئة بشأن سرعة تكوين هذا الطيّ.
إن عملية طي البروتين تتعرض أحيانا للمشاكل، فالبروتينات لديها ميل كبير لارتكاب أخطاء تبطئ من سرعتها كثيراً أثناء رحلتها المعقدة، إلى التركيب النهائي لها. ويتعين على البروتينات أن تنطوي بسرعة فائقة، إذ لو تأخرت في مرحلة بينيّة واحدة، لتعرضت للتكتل مع بروتينات أخرى، أثناء عملية الطي، وهذا ربما يكون مدمراً للخلية، حيث تتحول هذه البروتينات إلى (بريونات) Prions أي بروتينات مُعْدِية، قد تصل إلى الخلايا العصبية في المخ وتقوم بتدميرها، تاركة فيها فجوات عديدة فيبدو النسيج العصبي كالإسفنج!
وقد اكتسب هذا المجال النشط من البحث العلمي، المزيد من الاهتمام في الوقت الحاضر إثر تزايد معرفتنا بأن أخطاء عملية طي البروتين، ربما تفضي إلى اضطرابات صحية خطيرة مثل مرض (الزهايمر) Alzheimer وأمراض الاعتلال الدماغي الإسفنجي Spongi from encephalopathies مثل مرض كرويتزفيلد جاكوب وهو الشكل البشري لمرض (جنون البقر).
الرقصة البيولوجية
في أواخر الثمانينيات من القرن العشرين،اكتشف علماء البيولوجيا أن الخلايا تحتوي على جزيئات خاصة مرافقة، هي نفسها عبارة عن بروتينات يطلق عليها (البروتينات المقترنة) Molecular Chaperones،
وتساعد البروتينات المقترنة في توجيه جزيئات البروتينات غيركاملة النضج بعيداً عن المؤثرات السيئة، وكذلك حمايتها لكي تنطوي بالطريقة الصحيحة. وطالما أصيب الباحثون بالدهشة من هذا (التعاون الجزيئي)، ومن ثم خضعت البروتينات المقترنة لأبحاث علمية دقيقة للتعرف على طبيعتها والدور الذي تقوم به في إتمام عملية طي البروتين.
ومن هذه الأبحاث، قيام العلماء بمعالجة بكتريا إنتاج (الأنسولين)، باستخدام تقنيات الهندسة الوراثية، حيث أوقفوا نشاط الجينات التي تدخل في عملية إنتاج البروتينات المقترنة. ونتج عن هذا موت البكتريا وهي (متجلطة) بكتل من البروتينات المجمّعة بطريقة خاطئة. ومن دون مساعدة البروتينات المقترنة الموجهة، تفشل نحو ثلاثين بالمائة من بروتينات البكتريا، في أن تنطوي بالشكل الصحيح.
ولكن كيف تقوم البروتينات المقترنة بوظيفتها، في مساعدة البروتين على اتخاذ الطيّة الصحيحة?. توجد البروتينات المقترنة في الخلية، ومن أهمها البروتين (جرويل) Groel والبروتين (جرويس) Groes مع وجود الأدينوسين ثلاثي الفوسفات Adenosine triphosphate (ATP)، الذي تخزن فيه الطاقة المستخرجة من الغذاء ثم تتوافر للتفاعلات الكيميائية في الخلية، ويعد هذا الجزئ المصدر الرئيسي للطاقة في الخلية.
ويكون شكل البروتينات المقترنة مثل عدة طبقات من (الكعك) الدائري الشكل، وتتجمع هذه الجزيئات مع بعضها البعض، لتكوّن مركباً معقداً من نوع ما.
وتتوافر المادة الرابطة (الغراء) من التجاذبات الرقيقة في بعض الأحماض الأمينية للبروتين.
وتنفذ هذه البروتينات المقترنة، المُناظر الكيميائي الحيوي، لرقصة بيولوجية معقدة، تضمها مع البروتين غير الناضج. ففي الخطوة الأولى يقوم (جرويس) بربط أذرعه بأحد طرفي (جرويل)، بحيث تشكل حلقاتها تجويفاً فارغاً كبيراً، بما يكفي لاستيعاب بروتين واحد. وفي الخطوة الثانية، يلتصق البروتين غير الناضج داخل هذا التجويف، كالخيط المشدود، حتى لا يتعرض لأي التواءات قبل الوقت المناسب، أثناء خروج البروتين من (ريبوسومات) الخلية إلى (السيتوبلازم) ليكمل رحلته داخل الجسم. ويقود ذلك إلى الخطوة الثالثة، حيث يشتبك (جرويس) بالطرف الآخر لـ (جرويل) مما يؤدي إلى تحرر البروتين من (سجنه) داخل التجويف، بواسطة الطاقة التي يحصل عليها من الأدينوسين ثلاثي الفوسفات. وبهذا يصبح البروتين حراً بعد حمايته داخل (القفص الجزيئي) في التجويف، من أي مــؤثــرات خارجـية ضـارة به.
وهكذا تنتهي المشكلة، ويتمكن البروتين من أن ينطوي بطريقة صحيحة.
ولكن يعتقد بعض الباحثين، أن البروتينات المنتشرة تربط أذرعها مع البروتينات المقترنة فقط بشكل متقطع، وأن معظم عملية الطي تتم أثناء انفصالها، وكذلك ربما تستخدم البروتينات المقترنة الأدينوسين ثلاثي الفوسفات، في (نجدة) البروتينات (المحبوسة) في حالات طي خاطئة، وإعطائها فرصة أخرى، ثم تطلق هذه البروتينات التي تم إنقاذها وتتركها لكي تنطوي تلقائياً.
فإذا انطوى البروتين بالشكل الصحيح، فكل شيء على ما يرام، أما في حالة حدوث أي مشكلة، تقوم البروتينات المقترنة بنجدته مرة أخرى، وهكذا تحصل معظم البروتينات على فرص كافية، لكي تصل إلى الطيّة الصحيحة في النهاية.
نمذجة طي البروتين
آفاق المستقبل
لقد لعب طي البروتين دوراً رئيسياً في كل من الأبحاث والتطورات الأكاديمية والصناعية في مجال التكنولوجيا الحيوية. إذ اعتمدت الصناعات التكنولوجية الحيوية على عمليات طي البـروتين، في الخلايا الحية In vivo وكذلك في المعامل (في أنابيب الاختبار) In Vitro للإنتاج الناجح للبروتينات المصنّعة، المعتمد استخدامها حالياً في العلاج الطبي واستنباط أدوية علاجية جديدة في المستقبل القريب.
ولهذا، فإن لغز طي البروتين، أصبح في بؤرة الاهتمام العلمي في الوقت الحاضر، خاصة بعد التوصل إلى الشكل الأولي للطاقم الوراثي البشري (الجينوم) وبداية الأبحاث الخاصة بالكشف عن تعاقبات الأحماض الأمينية في البروتينات.
طالع أيضاً
الهامش
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). "The Shape and Structure of Proteins". Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 978-0-8153-3218-3.
المصادر
مجلة العربي: طي البروتين - رءوف وصفي تصريح
وصلات خارجية
- FoldIt - Folding Protein Game
- Folding@Home
- Rosetta@Home
- Human Proteome Folding Project
- BHAGEERATH-H: Protein tertiary structure prediction server
- http://www.englandlab.com/protein-folding.html