خلية جدارية (معدة)
| الخلية الجدارية Parietal cell | |
|---|---|
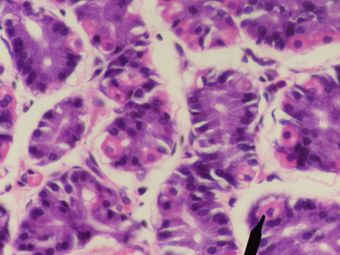 خلايا جدارية بشرية (باللون الوردي) - المعدة. | |
 التحكم في العصارة الهضمية. | |
| Details | |
| الموقع | المعدة |
| الوظيفة | إفراز العصارة الهضمية، العامل الداخلي |
| Identifiers | |
| اللاتينية | exocrinocytus parietalis |
| MeSH | D010295 |
| TH | TH {{{2}}}.html HH3.04.02.1.00033 .{{{2}}}.{{{3}}} |
| المصطلحات التشريحية | |
الخلايا الجدارية وتُعرف أيضاً بالخلايا المفرزة للحمض oxyntic أو الخلايا محددة الشكل delomorphous cells)، هي خلايا طلائية تُفرز حمض الهيدروكلوريك والعامل الداخلي. تقع هذه الخلايا في الغدد المعدية الموجودة في بطانة قاع وجسم المعدة.[1] تحتوي الخلايا الجدارية على شبكة إفرازية واسعة (القنيوات) والتي يُفرز من خلالها حمض الهيدروكلوريك عن طريق النقل النشط داخل المعدة. تتميز الخلايا الجدارية بوجود انزيم أتپيز الهيدروجين پوتاسيوم (H+/K+ ATPase) الذي ينقل أيونات الهيدروجين بعجس تدريج التركيز بحوالي 3-1 مليون، وهو أكثر ميل أيوني انحدارًا في جسم الإنسان. الخلايا الجداريّة تُنظَّم أولاً عن طريق هستامين، واستيل كولين، وگاسترين بإشارة من كلا المضامين المركزية والموضعية (انظر التنظيم).
التكوين
القنيوات
القنيوات هي تكيف يوجد على الخلايا الجداريّة المعديّة. وهي عبارة عن طيات عميقة أو قنوات صغيرة، تقوم بزيادة مساحة السطح، مثال: للإفراز. غشاء الخلايا الجدارية متحرك؛ عدد القنيوات يزداد ويقلّ تبعًا للحاجة الإفرازية. هذا يتمّ تنفيذه من خلال اندماج المولدات القنيوية أو نبيب الحويصلات مع الغشاء لزيادة مساحة السطح، والالتقام (الابتلاع) المتبادل للقنيوات (إعادة تشكيل نبيب الحويصلات) لتقليلها.
الوظيفة
إفراز حمض الهيدروكلوريك
يتكون حمض الهيدروكلوريك من خلال الأسلوب التالي:
- يتكون أيون الهيدروجين عن طريق تفكك حمض الكربونيك. يعد الماء مصدر ثانوي لأيونات الهيدروجين بالمقارنة مع حمض الكربونيك. يتكون حمض الكربونيك من ثاني أكسيد الكربون والماء بمساعدة الأنهيدراز الكربونية.
- يتم تبادل أيون هيدروجين الكربونات (-HCO3) مع أيون الكلوريد (CL-) على الجانب القاعدي للخلية. ويَنتَشِر أيون هيدروجين الكربونات (-HCO3) إلى الدم الوريدي مما يؤدي إلى ظاهرة المد القلوي.
- تنتشر أيونات البوتاسيوم وأيونات الكلور إلى القنيوات.
- يتم ضخ أيونات الهيدروجين خارج الخلية إلى القنيوات بالتبادل مع أيونات الپوتاسيوم بواسطة انزيم أتپيز الهيدروجين پوتاسيوم (H+/K+ ATPase). يزداد عدد هذه المستقبلات على الجانب اللُمْعي بواسطة انْدِماج نبيب الحويصلات (غير متأكدة) أثناء تنشيط الخلايا الجدارية، ويتم إزالتها أثناء التّوقُّف (إلغاء التنشيط). يحافظ هذا المستقبل على فارق مليون ضعف في تركيز البروتون. ثُلاثِي فُسْفاتِ الأَدِينُوزِين نحصل عليه بواسطة عدد من الميتوكندريا.
يؤدِّي التّصدير الخلويّ لأيونات الهيدروجين إلى إبقاء التّجويف المعديّ ذي بيئة حمضيّة بدرجة عالية. تساعد الحمضية في هضم الطعام بواسطة تكشّف (إفساد) البروتين المُبتلَع. عند تكشّف البروتينات، الرّوابط الببتيديّة التي تربط الأحماض الأمينيّة تصبح مكشوفة. سيقوم حمض الهيدروكلوريك المَعِدِيّ في نفس الوقت بتنشيط مُولِّد الببسين (البيبسينوجين)، وهو بِبْتيداز داخليّ (إنزيم) والذي يقوم بخطوة للأمام في عملية الهضم بواسطة كسر الروابِط البِبْتيدِيّة المكشوفة الآن، وتُسمَّى هذه العمليّة بتحَلَّل البروتين.
التنظيم
تُفرز الخلايا الجداريّة الحمض استجابة لثلاثة أنواع من المُنبِّهات (المُحفِّزات):[2]
- هيستامين: يقوم بتحفيز مستقبلات الهستامين هـ1 (المُساهِم الأكثر الأهميّة).
- أسيتيل كولين: من النّشاط اللاودي بواسطة العصب المُبهَم (العصب القحفيّ العاشر) والجهاز العصبيّ المعويّ، يقوم بتحفيز م3.[3]
- جاسترين: يقوم بتحفيز مستقبلات كُولِيسِيسْتوكِينين 2 (المُساهِم الأقل الأهميّة، ولكن أيضًا يُسبِّب إفراز الهيستامين بواسطة الخَلِايا المِعَوِيَّة أَليفَة الكروم المحليّة).
يؤدِّي تنشيط الهيستامين خلال مستقبل هـ 1 إلى زيادة مستوى أُحادِيّ فُسْفاتِ الأَدينُوزِين الحلقيّ الخلويّ، بينما يقوم أسيتيل كولين خلال مستقبل م3 وجاسترين خلال مستقبل كوليسِيستوكينين 2 بزيادة مستوى الكالسيوم الخلويّ. تُوجَد هذه المستقبلات على الجانب القاعديّ للغشاء. تُؤدِّي زيادة أُحاديّ فسفات الأَدينوزين الحلقيّ إلى زيادة بروتين كيناز أ. يقوم بروتين كيناز أ بإضافة الفسفور إلى البروتينات المشاركة في نقل انزيم أتپيز الهيدروجين پوتاسيوم (( H+/K+ ATPase من السيتوبلازم إلى غشاء الخلية. مما يُسبِّب امتصاص أيونات البوتاسيوم وإفراز أيونات الهيدروجين. الرقم الهيدروجيني للسائل المُفرَز قد يقل بمقدار 0.8. يحفِّز جاسترين أولاً إفراز الحمض بشكل غير مباشر، وزيادة تكوين هيستامين في الخَلايا المِعَويَّة أَليفَة الكروم، والتي بدورها تقوم بالإشارة إلى الخلايا الجداريّة بواسطة إطلاق هيستامين أو بتنبيه هـ2.[4] لا يملك جاسترين نفسه أيّ تأثير على إفراز الحمض المعويّ المحفِّز للهستامين.[5] تأثير هيستامين، وأسيتيل كولين، وجاسترين هو تأثير مُؤازِر، فتأثير الاثنين في الوقت نفسه أكثر تأثيرًا من جمع تأثير الاثنين بشكل منفرد. وهو يساعد في الزيادة غير الخطيّة للإفراز مع التنبيه فسيولوجيًا.[6]
إفراز العامل الداخلي
تقوم الخلايا الجداريّة أيضًا بإنتاج العامِل الدَّاخِليّ. يقوم العامِلُ الدَّاخِليّ بامتصاص فيتامين ب12 في النّظام الغذائيّ. نقص فيتامين ب12 لمدة طويلة يؤدي إلى فقر الدَّمِ الضَّخم الأَرومات، والذي يتميز بكريات الدّم الحمراء الهشّة الكبيرة. فقر الدم الخبيث (فقر الدَّم الوَبيل) والذي ينتج بسبب تدمير المناعة الذاتيّة للخلايا الجداريّة المعديّة، مما يمنع إنتاج العامِل الدَّاخِلِيّ؛ وبالتالي عدم امتصاص فيتامين ب12. يؤدِّي فقر الدّم الخبيث أيضًا إلى فقر الدَّمِ الضَّخم الأَرومات. سيؤدِّي التِهابُ المَعِدةِ الضُّموريّ -خاصّةً عند كبار السنّ– إلى عدم القدرة على امتصاص فيتامين ب12، وقد يؤدي إلى عدة قصور، مثل: تقليل تكوين الحمض النوويّ المنزوع الأكسجين (DNA)، وأيض النيوكليوتيد في نخاع العظم.
الأهمية السريرية
- قد تنتج القرحة المعديّة بسبب الحموضة الزّائدة في المعدة. قد تُستخدَم مضادّات الحموضة في تعزيز التّحمّل الطّبيعيّ لبطانة المعدة. تستطيع أدوية مُضادُّ المُسْكارين تقليل إفراز الحمض، مثل: بايرينزيبين أو مضاد الهيستامين هـ2. أدوية مُثبِّطات مضخة البروتون هي أكثر فعاليّة في تقليل إنتاج الحمض؛ لأنّ ذلك هو المسار النهائيّ المشترك لجميع مُحفِّزات إنتاج الحمض.
- في فقر الدم الخبيث، تتجه الأجسام المضادة الذاتيّة بعكس الخلايا الجداريّة أو العامل الداخليّ مما يؤدِّي إلى تقليل امتصاص فيتامين ب12. وقد يُعالَج عن طريق حقن تعويضيّ فيتامين ب12، مثل: ميثيل كوبالامين أو هيدروكسوكوبالامين أو سيانوكوبالامين.
- فَقْدُ حَمْضِ المَعِدَة: هو مرض آخر من أمراض المناعة الذاتيّة للخلايا الجداريّة. الخلايا الجداريّة المُتضرِّرة غير قادرة على إنتاج الكمّيّة المطلوبة من حمض المعدة. وهذا يؤدِّي إلى زيادة الرقم الهيدروجيني للمعدة، وإعاقة هضم الطعام، وزيادة خطر الالتهاب المعديّ المعويّ.
انظر أيضاً
- خلية معدية رئيسية
- هضم
- ارتجاع معدي مريئي
- اكتشاف وتطور مستقبلات مضخة الپروتون
- قائمة أنواع الخلايا البشرية المشتقة من طبقات التبرعم
المصادر
- ^ Hunt, A; Harrington, D; Robinson, S (4 September 2014). "Vitamin B12 deficiency" (PDF). BMJ. 349: g5226. doi:10.1136/bmj.g5226. PMID 25189324. Archived from the original (PDF) on 12 March 2017.
{{cite journal}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help)قالب:Free access - ^
{{cite book}}: Empty citation (help) - ^ "Gastric acid secretion - Homo sapiens". KEGG. Retrieved June 1, 2011.
- ^ Waldum, Helge L., Kleveland, Per M., et al. (2009)'Interactions between gastric acid secretagogues and the localization of the gastrin receptor',Scandinavian Journal of Gastroenterology,44:4,390 — 393
- ^ Kleveland PM, Waldum HL, Larsson M. Gastric acid secretion in the totally isolated, vascularly perfused rat stomach. A selective muscarinic-1 agent does, whereas gastrin does not, augment maximal histamine-stimulated acid secretion. Scand J Gastroenterol 1987;/22:/705�13.
- ^
{{cite book}}: Empty citation (help)
وصلات خارجية
- Illustration of Chief cells and Parietal cells at anatomyatlases.org
- The Parietal Cell: Mechanism of Acid Secretion at vivo.colostate.edu
- Histology at BU 11303loa - Digestive System: Alimentary Canal: fundic stomach, gastric glands, lumen"
- Physiology at MCG 6/6ch4/s6ch4_8
- Physiology at MCG 6/6ch4/s6ch4_14
- Parietal cell antibody
- Antibody to GPC
