عضوانية
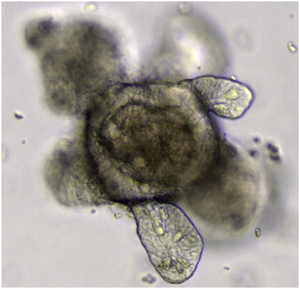
العضوانية (organoid)، هي نسخة مصغرة ومبسطة من عضو تم إنتاجه في المختبر في ثلاثة أبعاد تحاكي التعقيد الوظيفي والبنيوي والحيوي الرئيسي لهذا العضو.[1]
تُنتج العضوانية من خلية واحدة أو عدد قليل من خلايا [[نسيج حيوي|الأنسجة] أو الخلايا الجذعية الجنينية أو الخلايا الجذعية متعددة القدرات المستحثة، والتي يمكنها تنظيم نفسها في مزرعة ثلاثية الأبعاد نظراً لقدراتها على تجديد الخلايا الجذعية وتمايزها. لقد تحسنت تقنية زراعة الأعضاء بسرعة منذ أوائل ع. 2010، ووصفتها مجلة ذا ساينتست بأنها واحدة من أكبر التطورات العلمية عام 2013.[2] يستخدم العلماء والمهندسون الأعضاء لدراسة التطور والأمراض في المختبر، لاكتشاف الأدوية وتطويرها في الصناعة،[3] التشخيص والعلاج الشخصي، والعلاج الجيني والخلوي، وهندسة الأنسجة، والطب التجديدي.
التاريخ
بدأت محاولات تخليق أعضاء في المختبر بواحدة من أولى تجارب التفكك-إعادة التجميع[4] حيث أثبت هنري ڤان پيترز ويلسون أن الخلايا الإسفنجية المفككة ميكانيكياً يمكنها إعادة التجمع وتنظيم نفسها لتوليد عضية كاملة.[5] في العقود اللاحقة، تمكنت العديد من المختبرات من تخليق أنواع مختلفة من الأعضاء[4] في المختبر من خلال تفكيك وإعادة تجميع أنسجة الأعضاء المأخوذة من البرمائيات[6] والفراخ الجنينية.[7] رُصد تكوين أول مستعمرات شبيهة بالأنسجة في المختبر لأول مرة من خلال زراعة الخلايا الكيراتينية والأرومات الليفية 3T3 معاً.[8] وقد أدت ظاهرة الخلايا المنفصلة ميكانيكياً والتي تتجمع وتعيد تنظيم نفسها لإعادة تشكيل الأنسجة التي تم الحصول عليها منها لاحقاً إلى تطوير فرضية الالتصاق التفاضلي بواسطة مالكولم شتاينبرگ.[4] مع ظهور مجال علم أحياء الخلايا الجذعية، تم إدراك إمكانية الخلايا الجذعية لتكوين أعضاء في المختبر في وقت مبكر مع ملاحظة أنه عندما تشكل الخلايا الجذعية أوراماً مسخيةً أو أجساماً جنينية، يمكن للخلايا المتمايزة أن تنظم نفسها في هياكل مختلفة تشبه تلك الموجودة في أنواع متعددة من الأنسجة.[4] بدأ ظهور مجال العضويات، بالتحول من زراعة الخلايا الجذعية وتمييزها في مستنبتات ثنائية الأبعاد (2D)، إلى مستنبتات ثلاثية الأبعاد (3D) للسماح بتطوير الهياكل المعقدة ثلاثية الأبعاد للأعضاء.[4] أصبح من الممكن الاستفادة من أساليب المستنبتات ثلاثية الأبعاد للتنظيم الهيكلي من خلال تطوير الأنسجة البينية خارج الخلية.[9] في أواخر الثمانينيات، أظهر بيسل وزملاؤه أنه يمكن استخدام هلام غني باللامينين كغشاء قاعدي للتمايز والتكوين في مزارع الخلايا الظهارية الثديية.[10][11] منذ عام 1987، ابتكر الباحثون طرقاً مختلفة للاستنبات ثلاثي الأبعاد، وتمكنوا من استخدام أنواع مختلفة من الخلايا الجذعية لتخليق عضويات تشبه العديد من الأعضاء.[4] في التسعينيات، بالإضافة إلى دورها في الدعم المادي، أُعلن عن دور مكونات الأنسجة البينية خارج الخلية في التعبير الجيني من خلال تفاعلها مع مسارات الالتصاق البؤري القائمة على الإنترجرين.[12] في عام 2006، أظهر ياكوڤ نحمياس وديڤيد أودي التجميع الذاتي لعضوانية الكبد الوعائية المحفوظة لأكثر من 50 يوماً في المختبر.[13] عام 2008، أثبت يوشيكي ساساي وفريقه في معهد ريكن أن الخلايا الجذعية يمكن تحويلها إلى كرات من الخلايا العصبونية التي تنظم نفسها إلى طبقات مميزة.[14] عام 2009، أظهر مختبر هانز كليڤرز في معهد هوبريخت والمركز الطبي الجامعي في أوتريخت، هولندا، أن الخلايا الجذعية المعوية المعبرة عن LGR5 تنظم نفسها إلى هياكل زغابات غشائية "في المختبر" دون الحاجة إلى موضع متعلق باللحمة الوسطى، مما يجعلها أول عضوانيات.[15] عام 2010، قام ماثيو أونبيكاندت وجيمي ديڤز بإثبات إنتاج العضوانيات الكلوية من الخلايا الجذعية الكلوية المشتقة من أجنة الفئران.[16] في عام 2014، قام تشون وانگ وزملاؤه بتصميم مواد هلامية تعتمد على الكولاجين-1 واللامينين ومواد حيوية رغوية صناعية لاستنبات وتوصيل العضوانيات المعوية[17] وجزيئات الذهب النانوية الوظيفية المغلفة بالحمض النووي في عضوانيات معوية لتشكيل حصان طروادة معوي لتوصيل الأدوية والعلاج الجيني.[18] أظهرت التقارير اللاحقة وظيفة فسيولوجية هامة لهذه العضوانيات في المختبر[19] وفي الجسم الحي.[20][21]
ومن بين التطورات المبكرة الهامة الأخرى التي تم تحقيقها عام 2013، قيام مادلين لانكستر في معهد التكنولوجيا الحيوية الجزيئية التابع لأكاديمية العلوم النمساوية بإنشاء پروتوكول يبدأ من الخلايا الجذعية متعددة القدرات لتوليد عضوانيات دماغية تحاكي التنظيم الخلوي للدماغ البشري المتطور.[22] أثبت مريتكسل هوتش وكريگ دوريل في معهد هوبرخت والمركز الطبي الجامعي في أوتريخت أن خلايا Lgr5+ الفردية من كبد الفأر التالف يمكن استنساخها كعضوانيات كبدية في وسط مستنبت قائم على Rspo1 على مدى عدة أشهر.[23] عام 2014، أظهر أرتيم شكوماتوڤ وآخرون في جامعة إلينوي في أوربانا-شامپين أن الأعضاء القلبية الوعائية يمكن أن تتكون من خلايا جذعية جنينية من خلال تعديل صلابة الركيزة التي تلتصق بها. وقد عززت الصلابة الفسيولوجية ثلاثية الأبعاد للأعضاء القلبية الوعائية وتمايز عضلة القلب.[24]
الخصائص
عرف لانكستر ونوبليتش[4] العضوانية على أنها مجموعة من أنواع الخلايا الخاصة بالأعضاء والتي تتطور من الخلايا الجذعية أو أسلاف الأعضاء، وتنظم نفسها من خلال فرز الخلايا والالتزام بالسلالة المقيدة مكانيًا بطريقة مماثلة لما يحدث في الجس الحي، وتظهر الخصائص التالية:
- تحتوي على أنواع متعددة من الخلايا الخاصة بكل عضو؛
- تكون قادرة على تكرار بعض الوظائف المحددة للعضو (على سبيل المثال الانقباض، النشاط العصبي، الإفرازات الصماء، الترشيح، الإخراج)؛
- خلاياها متجمعة مع بعضها ومنظمة مكانياً، على غرار الأعضاء.
العملية
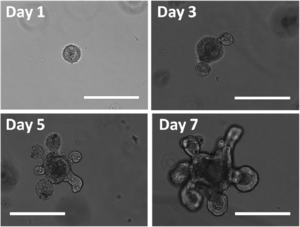
يتطلب تشكل العضوانيات بشكل عام زراعة الخلايا الجذعية أو الخلايا السلفية في مستنبت ثلاثي الأبعاد.[4] تتمتع الخلايا الجذعية بالقدرة على تجديد نفسها والتمايز إلى أنواع فرعية مختلفة من الخلايا، وتمكن من فهم عمليات التطور وتطور المرض.[25] لذلك فإن العضوانيات المشتقة من الخلايا الجذعية تمكن من دراسة علم الأحياء وعلم وظائف الأعضاء على مستوى العضو.[26] يمكن صنع المستنبت ثلاثي الأبعاد باستخدام نسيج بيني خارج الخلية هلامي مائي مثل الماتريجل أو كلتركس بي إم إي، وهو نسيج بيني خارج الخلية غني باللامينين والذي تفرزها سلالة ورم Engelbreth-Holm-Swarm.[27] يمكن بعد ذلك تخليق أجسام عضوانية من خلال تضمين الخلايا الجذعية في المستنبت ثلاثي الأبعاد.[4]
عند استخدام الخلايا الجذعية متعددة القدرات لتخليق عضوانية، يُسمح للخلايا عادةً، ولكن ليس في جميع الأوقات، بتكوين أجسام جنينية.[4] يتم بعد ذلك معالجة هذه الأجسام الجنينية دوائياً باستخدام عوامل النمذجة لدفع تكوين هوية العضوانية المرغوبة.[4] كما تم تخليق العضوانيات باستخدام الخلايا الجذعية البالغة المستخرجة من العضو المستهدف، وزراعتها في مستنبت ثلاثي الأبعاد.[28]
دُمجت الإشارات الكيميائية الحيوية في مستنبتات العضوانيات ثلاثية الأبعاد ومع التعرض للمورفوجينات أو مثبطات المورفوجين أو عوامل النمو، يمكن تطوير نماذج العضوانيات باستخدام الخلايا الجذعية الجنينية (ESCs) أو الخلايا الجذعية البالغة (ASCs). يمكن الاستفادة من تقنيات تكوين الأوعية الدموية لتجسيد البيئات الدقيقة القريبة من نظيراتها، فسيولوجياً. يمكن تحقيق أنظمة الأوعية الدموية التي يمكنها تسهيل وصول الأكسجين أو العناصر الغذائية إلى الكتلة الداخلية للأعضاء من خلال أنظمة السوائل الدقيقة وأنظمة توصيل عامل نمو بطانة الأوعية الدموية ووحدات مغلفة بالخلايا البطانية.[9] مع الخلايا الجذعية متعددة القدرات المستحثة (iPSCs)[29] وتحرير الجينوم القائم على تقنيات كريسپر/كاس[30] يمكن تخليق خلايا جذعية متعددة القدرات (PSCs) معدلة الجينوم أو متحولة بإشارات متغيرة للتحكم في الإشارات الجوهرية داخل العضوانيات.
الأنواع
أُعيد تشكيل العديد من هياكل الأعضاء باستخدام العضوانيات.[4] يهدف هذا القسم إلى تحديد حالة هذا المجال حتى الآن من خلال تقديم قائمة مختصرة للعضوانيات التي تخليقها بنجاح، بالإضافة إلى مخطط موجز يعتمد على أحدث الأدبيات لكل عضوانية، وأمثلة حول كيفية استخدامها في الأبحاث.
العضوانيات الدماغية
يصف مصطلح العضوانية الدماغية، الأعضاءً المصغرة المستنبتة صناعياً في المختبر، الشبيهة بالدماغ. يتم تخليق العضوانيات الدماغية عن طريق استنبات الخلايا الجذعية متعددة القدرات في بنية ثلاثية الأبعاد باستخدام مفاعل حيوي دوار وتتطور على مدار أشهر.[22] إن هذا الإجراء له تطبيقات محتملة في دراسة نمو الدماغ وعلم وظائفه. فقد تشعر العضوانيات الدماغية بـ "أحاسيس بسيطة" استجابة للتحفيز الخارجي، ويعرب علماء الأعصاب عن قلقهم من أن مثل هذه العضوانيات قد تتطور لديها القدرة على الإحساس. ويقترحون أن أي تطور إضافي لهذه التقنية لابد وأن يخضع لإجراءات إشرافية صارمة.[31][32][33]
عام 2023، قام الباحثون ببناء حاسوب حيوي هجين يجمع بين عضوانيات الدماغ البشري المستنبتة في المختبر والدوائر التقليدية، ويمكنه إكمال مهام مثل التعرف على الصوت.[34] تُستخدم العضوانيات الدماغية حالياً للبحث والتطوير في تقنيات الذكاء العضوي (OI).[35]
العضوانيات الهضمية
تشير العضوانيات الهضمية إلى الأعضاء التي تلخص بنى القناة الهضمية. تنشأ القناة الهضمية من الأديم الباطن، والذي يشكل أثناء التطور أنبوباً يمكن تقسيمه إلى ثلاث مناطق مميزة، والتي تؤدي، جنباً إلى جنب مع الأعضاء الأخرى، إلى الأقسام التالية من القناة الهضمية:[4]
- يؤدي المعي الأمامي إلى تكوين تجويف الفم والمعدة
- يؤدي المعي المتوسط إلى ظهور الأمعاء الدقيقة والقولون الصاعد
- يؤدي المعي الخلفي إلى ظهور المستقيم وبقية القولون
تم تخليق العضوانيات للبنى التالية في القناة الهضمية:
العضوانيات المعوية
كانت العضوانيات المعوية[15] حتى الآن من بين عضوانيات الأمعاء التي تم تخليقها مباشرة من الأنسجة المعوية أو الخلايا الجذعية متعددة القدرات.[4] يمكن دفع الخلايا الجذعية البشرية متعددة القدرات لتكوين عضيات معوية من خلال تطبيق أكتيڤين A أولاً لدفع الخلايا إلى هوية متوسطة الأديم، متبوعًا بالزيادة الدوائية في مسارات إشارات Wnt3a وFgf4 حيث ثبت أنها تعزز مصير الأمعاء الخلفية.[4] كما جرى تخليق العضوانيات المعوية أيضاً من الخلايا الجذعية المعوية، واستخراجها من الأنسجة البالغة وزراعتها في وسائط ثلاثية الأبعاد.[28] غالبًا ما يشار إلى هذه العضوانيات المخلقة من الخلايا الجذعية البالغة باسم العضوانيات المعوية أو القولونية، اعتمادًا على جزء المنشأ، وقد جرى تخليقها من أمعاء البشر والفئران.[15][36][37] تتكون العضوانيات المعوية من طبقة واحدة من الخلايا الطلائية المستقطبة المحيطة بتجويف مركزي. وبالتالي، فإنها تلخص بنية الزغابات المعوية، من خلال إعادة صياغة وظيفتها وعلم وظائف الأعضاء وتنظيمها، والحفاظ على جميع أنواع الخلايا الموجودة بشكل طبيعي في البنية بما في ذلك الخلايا الجذعية المعوية.[4]
وهكذا، فإن العضوانيات المعوية تشكل نموذجًا قيمًا لدراسة نقل العناصر الغذائية المعوية،[38][39] امتصاص الدواء وتوصيله،[40][41] مواد نانوية والطب النانوي،[42][43] إفراز هرمون الإنكرتين،[44][45] والعدوى بمسببات الأمراض المعوية المختلفة.[46][47] على سبيل المثال، قام فريق تشون وانگ بتصميم جزيئات نانوية اصطناعية من الڤيروسات بشكل عقلاني كمركبات توصيل للأدوية عن طريق الفم (ODDVs) باستخدام نماذج مخاطية مشتقة من العضوانيات المعوية[48] وأظهر مفهومًا جديدًا لاستخدام العضوانيات القولونية التي تخليقها مؤخراً كأدوات لفحص الأدوية عالية الإنتاجية واختبار السمية وتطوير الأدوية عن طريق الفم.[49] أو مؤخرًا، قام Sakib, S., وZou, S. بتطوير جسيمات نانوية من أكسيد الجرافين لتوصيل siRNA الذي ينظم التعبير عن عامل نخر الورم-ألفا، والذي يهدف إلى علاجات العضوانيات المعوية التي تظهر نمطًا التهابيًا.[50] كما تحاكي العضوانيات المعوية بنية الزغابات المعوية بدرجة عالية من الدقة لدرجة أنها زُرعت بنجاح في أمعاء الفئران، وبالتالي فهي تحظى بتقدير كبير باعتبارها نموذجًا قيمًا للبحث.[4] ومن مجالات البحث التي استخدمت العضوانيات المعوية فيها هو مجال الخلايا الجذعية. أُستخدمت العضوانيات المعوية لدراسة طبيعة الخلايا الجذعية المعوية، وقد أظهرت الأبحاث التي أجريت عليها الدور الإيجابي الذي يلعبه IL-22 في الحفاظ على الخلايا الجذعية المعوية،[51] إلى جانب توضيح أدوار أنواع أخرى من الخلايا مثل الخلايا العصبية والأرومات الليفية في الحفاظ على الخلايا الجذعية المعوية.[28] في مجال علم الأحياء المعدية، أُستكشفت أنظمة نموذجية مختلفة تعتمد على العضوانيات المعوية. من ناحية أخرى، يمكن إصابة العضوانيات بكميات كبيرة عن طريق خلطها ببساطة مع مسببات الأمراض المعوية موضع الاهتمام.[52] ومع ذلك، لنمذجة العدوى عبر مسار أكثر طبيعية بدءًا من تجويف الأمعاء، يلزم حقن مجهري للعامل الممرض.[53][54] بالإضافة إلى ذلك، يمكن عكس قطبية العضوانيات المعوية،[55] ويمكن حتى تفكيكها إلى خلايا مفردة وزراعتها كطبقات أحادية ثنائية الأبعاد[56][57] من أجل جعل الجانبين القمي والقاعدي من النسيج الطلائي أكثر سهولة في الوصول إليهما. كما أظهرت العضوانيات المعوية إمكانات علاجية.[58]
من أجل recapitulate الأمعاء بشكل أكثر دقة في الجسم الحي، تم تطوير مزارع مشتركة من العضوانيات المعوية والخلايا المناعية.[57] علاوة على ذلك، تجمع نماذج الأعضاء على الرقاقة بين العضوانيات المعوية وأنواع أخرى من الخلايا مثل الخلايا البطانية أو الخلايا المناعية بالإضافة إلى التدفق التمعجي.[59][60]
العضوانيات المعدية
recapitulate الأعضاء المعدية على الأقل جزئيًا فسيولوجيا المعدة. تم تخليق العضوانيات المعدية مباشرة من الخلايا الجذعية متعددة القدرات من خلال التلاعب الزمني بمسارات إشارات عامل نمو الخلايا الليفية FGF ومسار إشارات WNT ومسار إشارات پروتين العظام BMP وحمض الريتينويك وعامل نمو البشرة EGF في مزرعة ثلاثية الأبعاد.[61] كما تم تخليق عضوانيات معدية باستخدام خلايا جذعية معدية بالغة تعبر عن LGR5.[62] وقد أُستخدمت العضوانيات المعدية كنموذج لدراسة السرطان[63][64] والأمراض البشرية [61] والتطور.[61] فعلى سبيل المثال، بحثت إحدى الدراسات[64] التغيرات الجينية الأساسية وراء انتشار الورم النقيلي لدى مريض، وتوصلوا إلى أنه على عكس الورم الأساسي لدى المريض، فإن الورم النقيلي يحتوي على كلا الأليلين من جين TGFBR2 المتحول. لتقييم دور TGFBR2 في انتشار الورم النقيلي بشكل أكبر، أنشأ الباحثون أعضاء حيث يتم تثبيط التعبير عن TGFBR2، ومن خلال ذلك تمكنوا من إثبات أن انخفاض نشاط TGFBR2 يؤدي إلى غزو الأورام السرطانية وانتشارها في المختبر وفي الجسم الحي.
العضوانيات اللسانية
العضوانيات اللسانية هي عضوانيات تلخص، على الأقل جزئيًا، جوانب من فسيولوجيا اللسان. تم تخليق عضيات لسانية ظهارية باستخدام الخلايا الجذعية الظهارية المعبرة عن BMI1 في ظروف زراعة ثلاثية الأبعاد من خلال التلاعب بعامل نمو البشرة وWNT وTGF-β.[65] ومع ذلك، تفتقر مزرعة العضوانيات هذه إلى مستقبلات التذوق، حيث لا تنشأ هذه الخلايا من الخلايا الجذعية الظهارية التي تعبر عن Bmi1.[65] إلا أنه جرى تخليق عضوانيات براعم التذوق اللسانية التي تحتوي على خلايا التذوق باستخدام الخلايا الجذعية/السلفية LGR5+ أو CD44+ من أنسجة الحليمة المحيطة (CV).[66] خُلقت عضوانيات براعم التذوق هذه بنجاح من الخلايا الجذعية/السلفية المعزولة المعبرة عن Lgr5 أو LGR6[67] وبشكل غير مباشر، من خلال عزل وهضم وزراعة أنسجة الخلية الجذعية التي تحتوي على خلايا جذعية/سلفية Lgr5+ أو CD44+.[66]
أخرى
عضوانيات الأسنان (TO)[68] (انظر أيضاً تجدد الأسنان)
- تلخص العضوانيات الزعترية على الأقل جزئيًا بنية ووظيفة يبئة الخلايا الجذعية للغدة الزعترية،[71] وهو عضو لمفاوي تنضج فيه الخلايا التائية. وقد خُلقت العضوانيات الزعترية من خلال زرع خلايا جذعية من الغدة الزعترية في مزرعة ثلاثية الأبعاد.[71] يبدو أن العضوانيات الزعترية تعيد بنجاح وظيفة الغدة الزعترية، حيث أدى زرع الخلايا الجذعية المكونة للدم أو نخاع العظم البشرية مع العضوانيات الزعترية للفئران إلى إنتاج خلايا تائية.[71]
- العضوانيات الخصوية [72]
- عضوانيات الپروستاتا[73]
- العضوانيات الكبدية.[74] أظهرت دراسة حديثة فائدة هذه التقنية في تحديد أدوية جديدة لعلاج التهاب الكبد الڤيروسي هـ، حيث تسمح بتكرار دورة حياة الڤيروس بالكامل.[75]
- العضوانيات الپنكرياسية [76][77][78][79]
- أتاحت التطورات الحديثة في ألواح ميكروتيتر طاردة للخلايا فحصًا سريعًا وفعّالاً من حيث التكلفة لمكتبات الأدوية الجزيئية الصغيرة الكبيرة الحجم ضد النماذج ثلاثية الأبعاد لسرطان الپنكرياس. وتتوافق هذه النماذج في النمط الظاهري وملامح التعبير مع تلك الموجودة في مختبر الدكتور ديڤد توڤسون.
- العضوانيات الظهارية [15][80]
- العضوانيات الرئوية [81]
- العضوانيات الكلوية [16][82][83][84]
- الگاسترولويد (العضوانيات الجنينية)[85][86][87][88] – تولد جميع المحاور الجنينية وينفذ بشكل كامل أنماط التعبير الجيني المتوازية Hox على امتداد المحور الأمامي الخلفي.[88]
- البلستويد (العضوانيات الشبيهة بالبلاستوسايت)[89][90][91]
- العضوانيات البطانية [92]
- العضوانيات القلبية [93] – عام 2018، تم تخليق العضوانيات القلبية المجوفة لتنبض، وتستجيب للمحفزات لتنبض بشكل أسرع أو أبطأ.[94]
- العضوانيات الشبكية [95][96]
- عضوانيات سرطان الثدي[97]
- عضوانيات سرطان القولون[98]
- عضوانيات الورم الأرومي الدبقي[99]
إن النماذج العضانوية ثلاثية الأبعاد لسرطان المخ المشتقة إما من الطعوم المشتقة من المريض (PDX) أو مباشرة من أنسجة السرطان أصبحت الآن قابلة للتحقيق بسهولة وتوفر فحصًا عالي الإنتاجية لهذه الأورام ضد مجموعة الأدوية المعتمدة الحالية في جميع أنحاء العالم.
- عضوانيات الورم الأصم العصبي [100]
- المايلينويد (العضويات المايلينية)
- عضوانيات الحاجز الدموي الدماغي (BBB)[101]
تظهر التجمعات الخلوية ذاتية التجميع المكونة من خلايا نخاع العظام والخلايا النجمية والخلايا المحيطة بالأوعية الدموية كبديل محتمل لنماذج النقل عبر الأوعية والنماذج الميكروفلويدية لتطبيقات معينة. يمكن لهذه العضوانيات توليد العديد من سمات الحاجز الدموي الدماغي، مثل التعبير عن الوصلات الضيقة والناقلات الجزيئية ومضخات تدفق الأدوية، وبالتالي يمكن استخدامها لنمذجة نقل الأدوية عبر الحاجز الدموي الدماغي. كما يمكن أن تعمل كنموذج لتقييم التفاعلات بين الحاجز الدموي الدماغي والأنسجة الدماغية المجاورة وتوفير منصة لفهم القدرات المشتركة لدواء جديد للتغلب على الحاجز الدموي الدماغي وتأثيره على أنسجة المخ. بالإضافة إلى ذلك، فإن مثل هذه النماذج قابلة للتطوير بشكل كبير وأسهل في التصنيع والتشغيل من الأجهزة الميكروفلويدية. ومع ذلك، فإن قدرتها على إعادة بناء مورفولوجيا وفسيولوجيا الحاجز الدموي الدماغي محدودة وهي غير قادرة على محاكاة التدفق الفسيولوجي وإجهاد القص.
الأبحاث الأساسية
إن العضوانيات تمكن من دراسة كيفية تفاعل الخلايا معاً في العضو، وتفاعلها مع بيئتها، وكيفية تأثير الأمراض والأدوية عليها. إن الاستنبات "في المختبر" يجعل هذا النظام سهل تطويعه ومراقبته. وفي حين يصعب زراعة الأعضاء لأن حجمها يحد من اختراق العناصر الغذائية، فإن الحجم الصغير للعضوانيات يحد من هذه المشكلة. من ناحية أخرى، فهي لا تظهر جميع سمات العضو ولا يتم تلخيص التفاعلات مع الأعضاء الأخرى "في المختبر". بينما كان البحث في الخلايا الجذعية وتنظيمها هو المجال الأول لتطبيق العضوانيات المعوية،[15] فهي تُستخدم الآن أيضًا لدراسة امتصاص العناصر الغذائية ونقل الأدوية وإفراز هرمونات الإنكرتين.[102] ويعتبر هذا الأمر بالغ الأهمية في سياق أمراض سوء الامتصاص وكذلك الأمراض الأيضية مثل البدانة، مقاومة الأنسولين، ومرض السكري.
نماذج الأمراض
توفر العضوانيات فرصة لتخليق نماذج خلوية للأمراض البشرية، والتي يمكن دراستها في المختبر لفهم أسباب المرض بشكل أفضل وتحديد العلاجات الممكنة. ظهرت قوة العضوانيات في هذا الصدد لأول مرة في حالة وراثي من صغر الرأس، حيث أُستخدمت خلايا المريض لصنع العضوانيات الدماغية، والتي كانت أصغر حجمًا وأظهرت تشوهات في الجيل المبكر من الخلايا العصبية.[22] في مثال آخر، تم تطبيق نظام كريسپر لتحرير الجينوم على الخلايا الجذعية البشرية متعددة القدرات لإدخال طفرات مستهدفة في الجينات ذات الصلة بمرضين مختلفين في الكلى، مرض الكلى المتعدد الكيسات وتصلب الكبيبات القطعي البؤري.[83] تم بعد ذلك تنمية هذه الخلايا الجذعية متعددة القدرات المعدلة باستخدام كريسپرإلى عضوانيات كلوية بشرية، والتي أظهرت أنماطًا ظاهرية خاصة بالمرض. شكلت العضوانيات الكلوية من الخلايا الجذعية التي تحمل طفرات مرض الكلى المتعدد التكيسات هياكل كيسية شفافة كبيرة من الأنابيب الكلوية. عند زراعتها في غياب الإشارات الملتصقة (في حالة تعليق)، وصلت هذه الأكياس إلى أحجام 1 سم في القطر على مدى عدة أشهر.[103] طورت العضوانيات الكلوية التي تحتوي على طفرات في جين مرتبط بتصلب الكبيبات القطعي البؤري عيوبًا تقاطعية بين الخلايا الكبيبية، وهي الخلايا المرشحة المتأثرة بهذا المرض.[104] ومن المهم أن هذه الأنماط المرضية كانت غائبة في الأعضاء الضابطة ذات الخلفية الجينية المتطابقة، ولكنها تفتقر إلى طفرات كريسپر.[83][103][104] أشارت مقارنة هذه الأنماط الظاهرية العضوانية بالأنسجة المريضة من الفئران والبشر إلى وجود تشابه بين العيوب في التطور المبكر.[103][104]
كما تم تطويره لأول مرة بواسطة تاكاهاشي وياماناكا عام 2007، يمكن أيضًا إعادة برمجة الخلايا الجذعية متعددة القدرات المستحثة (iPSC) من الخلايا الليفية الجلدية للمريض.[105] تحمل هذه الخلايا الجذعية الخلفية الجينية الدقيقة للمريض بما في ذلك أي طفرات جينية قد تساهم في تطور الأمراض البشرية. تمايزت هذه الخلايا إلى عضوانيات كلوية من مرضى يعانون من متلازمة لو بسبب طفرات ORCL1.[106]
قارن هذا التقرير بين العضوانيات الكلوية المتمايزة من الخلايا الجذعية متعددة القدرات للمريض والخلايا الجذعية متعددة القدرات للتحكم غير ذات الصلة، وأظهر عدم قدرة الخلايا الكلوية للمريض على تحريك عامل النسخ SIX2 من مجمع گولجي.[106] نظرًا لأن SIX2 يعتبر علامة مميزة جيدًا لخلايا أسلاف الكليون في اللُحمة المتوسطة، فقد استنتج المؤلفون أن مرض الكلى الذي يُرى كثيرًا في متلازمة لو (فشل شامل في إعادة امتصاص الأنبوب القريب أو متلازمة فانكوني الكلوية) يمكن أن يكون مرتبطًا بالتغيير في نمط الكليون الناشئ عن خلايا أسلاف الكليون التي تفتقر إلى التعبير عن جين SIX2 المهم هذا.[106]
استخدمت دراسات أخرى تقنية كريسپر للتحرير الجيني لتصحيح طفرة المريض في خلايا iPSC للمريض لإنشاء عنصر تحكم isogenic، والذي يمكن إجراؤه في وقت واحد مع إعادة برمجة iPSC.[107][108][109] إن مقارنة العضوانية المشتقة من الخلايا الجذعية متعددة القدرات للمريض مع العضوانية متماثلة الجينات هو المعيار الذهبي الحالي في هذا المجال لأنه يسمح بعزل الطفرة المطلوبة كمتغير وحيد داخل النموذج التجريبي.[110] في أحد هذه التقارير، قورنت العضوانيات الكلوية المخلقة من الخلايا الجذعية المحفزة متعددة القدرات لمريض مصاب بمتلازمة ماينزر-سالدينو بسبب طفرات متغايرة الزيجوت مركبة في IFT140 بعضوانية تحكم متماثلة الجينات حيث تم تصحيح متغير IFT140 الذي أدى إلى ظهور نسخة mRNA غير قابلة للحياة بواسطة كريسپر.[108] أظهرت العضوانيات الكلوية لدى المريض شكلًا غير طبيعي للأهداب الأولية يتوافق مع نماذج الحيوانات الموجودة والتي تم إنقاذها إلى شكل النوع البري في العضوانيات المصححة للجينات.[108] سلطت المقارنة بين ملفات التعريف النسخية للخلايا الطلائية المنقاة من الأعضاء العضوية للمريض والضابط الضوء على المسارات المشاركة في استقطاب الخلية، التجمعات الخلوية ومحرك الداينين، والتي تم ربط بعضها بأنماط جينية أخرى ضمن العائلة الطلائية لاعتلال الأهداب الكلوي.[108] أظهر تقرير آخر يستخدم عنصر تحكم متساوي الجينات وجود توطين غير طبيعي النيفرين في الكبيبات من الأعضاء الكلوية الناتجة عن مريض يعاني من المتلازمة الكلوية الخلقية.[109]
يمكن أيضًا نمذجة أشياء مثل التمثيل الغذائي الظهاري.[111]
الطب الشخصي
أُستخدمت العضوانيات المعوية المزروعة من خزعات المستقيم باستخدام بروتوكولات المزراعة التي أنشأتها مجموعة كليڤرز لنمذجة التليف الكيسي،[112] وأدى ذلك إلى أول تطبيق للعضوانيات في العلاج الشخصي.[113] التليف الكيسي هو مرض وراثي يحدث بسبب طفرات في الجين المنظم لتوصيل الغشاء التليفي الكيسي الذي يشفر قناة أيونية ظهارية ضرورية لسوائل سطحية ظهارية صحية. وقد وصفت الدراسات التي أجراها مختبر جيفري بيكمان (مستشفى ڤلهلمينا للأطفال، المركز الطبي الجامعي في أوتريخت، هولندا) عام 2013 أن تحفيز العضوانيات القولونية-المستقيمية باستخدام منبهات رفع cAMP مثل فورسكولين أو سموم الكوليرا تسبب في تورم سريع للعضوانيات بطريقة تعتمد بشكل كامل على CFTR.[112] في حين تتضخم الأعضاء من الأشخاص غير المصابين بالتليف الكيسي استجابة للفورسكولين نتيجة لنقل السوائل إلى تجاويف العضوانيات، فإن هذا يقل بشدة أو يغيب في العضوانيات المشتقة من الأشخاص المصابين بالتليف الكيسي. يمكن استعادة التورم من خلال العلاجات التي تعمل على إصلاح پروتين CFTR (منظمات CFTR)، مما يشير إلى أنه يمكن تحديد الاستجابات الفردية للعلاج بتعديل CFTR في بيئة معملية ما قبل السريرية. عام عام 2013 أظهر شوانك وزملائه أيضًا أنه يمكن إصلاح النمط الظاهري للعضو المصاب بالتليف الكيسي المعوي عن طريق تحرير جين كريسپر-كاس9.[114]
كشفت دراسات المتابعة التي أجراها ديكرز وزملائه عام 2016 أن الاختلافات الكمية في التورم الناجم عن الفورسكولين بين العضوانيات المعوية المخلقة من الأشخاص المصابين بالتليف الكيسي ترتبط بعلامات تشخيصية وتنبؤية معروفة مثل طفرات جين CFTR أو المؤشرات الحيوية لوظيفة CFTR في الجسم الحي.[113] بالإضافة إلى ذلك، أظهر المؤلفون أن استجابات منظم CFTR في العضوانيات المعوية ذات الطفرات المحددة في CFTR كانت مرتبطة ببيانات التجارب السريرية المنشورة لهذه العلاجات. وقد أدى هذا إلى دراسات ما قبل السريرية حيث وجد أن العضوانيات المخلقة من المرضى الذين يعانون من طفرات CFTR النادرة للغاية والذين لم يتم تسجيل علاج لهم تستجيب بقوة لمنظم CFTR المتاح سريريًا. تأكدت الفائدة السريرية المقترحة للعلاج لهؤلاء الأشخاص بناءً على اختبار العضوانية ما قبل السريري لاحقًا عند التقديم السريري للعلاج من قبل أعضاء مركز التليف الكيسي السريري تحت إشراف كورس فان دير إنت (قسم أمراض الرئة للأطفال، مستشفى ڤلهلمينا للأطفال، المركز الطبي الجامعي في أوتريخت، هولندا). تُظهر هذه الدراسات لأول مرة أنه يمكن استخدام الأعضاء لتخصيص العلاج الفردي أو الطب الشخصي.
زراعة العضوانيات
إن خصائص التجديد الذاتي والتجدد التي تتمتع بها العضوانيات المعوية تجعلها مرشحة واعدة لعلاجات زارعة الأعضاء، وخاصة للأمراض التي تنطوي على خلل في الحاجز الظهاري. والجدير بالذكر أن زرع العضوانيات المعوية في الاثني عشر لدى الفئران أثبت أنه يساعد في شفاء الأضرار المخاطية لدى الفئران التي تعاني من إصابة نقص-إعادة التروية.[115]
أجريت أول عملية ناجحة لزراعة عضوانية داخل إنسان، وهو مريض يعاني من التهاب القولون التقرحي، وتم استخدام خلاياه في زراعة العضوانية، عام 2022.[116][117]
كنموذج لعلم الأحياء التنموي
توفر العضوانيات للباحثين نموذجاً استثنائياً لدراسة لعلم الأحياء التنموي.[118] منذ تحديد الخلايا الجذعية متعددة القدرات، حدثت تطورات كبيرة في توجيه مصير الخلايا الجذعية متعددة القدرات في المختبر باستخدام مستنبتات ثنائية الأبعاد.[118] سمحت هذه التطورات في اتجاه مصير الخلايا الجذعية متعددة القدرات، إلى جانب التطورات في تقنيات الزراعة ثلاثية الأبعاد، بتخليق عضوانيات تلخص خصائص مناطق فرعية محددة مختلفة من العديد من الأعضاء.[118] وقد ساهم استخدام هذه العضوانيات بشكل كبير في توسيع فهمنا لعمليات تخلق الأعضاء، ومجال علم الأحياء التنموي.[118] على سبيل المثال، في تطور الجهاز العصبي المركزي، ساهمت العضوانيات في فهمنا للقوى الفيزيائية التي تكمن وراء تشكل كأس الشبكية.[118][119] وقد أدت الأعمال الأحدث إلى تمديد فترات نمو العضوانيات القشرية على نطاق واسع، وفي غضون سنة تقريباً في ظل ظروف تمايز محددة، تظل العضوانيات قائمة ولديها بعض سمات مراحل نمو الجنين البشري.[120]
انظر أيضاً
المصادر
- ^ Zhao Z, Chen X, Dowbaj AM, Sljukic A, Bratlie K, Lin L, Fong EL, Balachander GM, Chen Z, Soragni A, Huch M, Zeng YA, Wang Q, Yu H (2022). "Organoids". Nature Reviews. Methods Primers. 2. doi:10.1038/s43586-022-00174-y. PMC 10270325. PMID 37325195.
- ^ Grens K (December 24, 2013). "2013's Big Advances in Science". The Scientist. Retrieved 26 December 2013.
- ^ Mullard A (March 2023). "Mini-organs attract big pharma". Nature Reviews. Drug Discovery. 22 (3): 175–176. doi:10.1038/d41573-023-00030-y. PMID 36797431.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ Lancaster MA, Knoblich JA (July 2014). "Organogenesis in a dish: modeling development and disease using organoid technologies". Science. 345 (6194): 1247125. doi:10.1126/science.1247125. PMID 25035496. S2CID 16105729.
- ^ Wilson HV (June 1907). "A New Method by Which Sponges May Be Artificially Reared". Science. 25 (649): 912–915. Bibcode:1907Sci....25..912W. doi:10.1126/science.25.649.912. PMID 17842577.
- ^ Holtfreter J (1944). "Experimental studies on the development of the pronephros". Rev. Can. Biol. 3: 220–250.
- ^ Weiss P, Taylor AC (September 1960). "Reconstitution of Complete Organs From Single-Cell Suspensions of Chick Embryos in Advanced Stages of Differentiation". Proceedings of the National Academy of Sciences of the United States of America. 46 (9): 1177–1185. Bibcode:1960PNAS...46.1177W. doi:10.1073/pnas.46.9.1177. PMC 223021. PMID 16590731.
- ^ Rheinwald JG, Green H (November 1975). "Formation of a keratinizing epithelium in culture by a cloned cell line derived from a teratoma". Cell. 6 (3): 317–330. doi:10.1016/0092-8674(75)90183-x. PMID 1052770. S2CID 28185779.
- ^ أ ب Yi SA, Zhang Y, Rathnam C, Pongkulapa T, Lee KB (November 2021). "Bioengineering Approaches for the Advanced Organoid Research". Advanced Materials. 33 (45): e2007949. Bibcode:2021AdM....3307949Y. doi:10.1002/adma.202007949. PMC 8682947. PMID 34561899.
- ^ Li ML, Aggeler J, Farson DA, Hatier C, Hassell J, Bissell MJ (January 1987). "Influence of a reconstituted basement membrane and its components on casein gene expression and secretion in mouse mammary epithelial cells". Proceedings of the National Academy of Sciences of the United States of America. 84 (1): 136–140. Bibcode:1987PNAS...84..136L. doi:10.1073/pnas.84.1.136. PMC 304157. PMID 3467345.
- ^ Barcellos-Hoff MH, Aggeler J, Ram TG, Bissell MJ (February 1989). "Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane". Development. 105 (2): 223–235. doi:10.1242/dev.105.2.223. PMC 2948482. PMID 2806122.
- ^ Streuli CH, Schmidhauser C, Bailey N, Yurchenco P, Skubitz AP, Roskelley C, Bissell MJ (May 1995). "Laminin mediates tissue-specific gene expression in mammary epithelia". The Journal of Cell Biology. 129 (3): 591–603. doi:10.1083/jcb.129.3.591. PMC 2120432. PMID 7730398.
- ^ Nahmias Y, Schwartz RE, Hu WS, Verfaillie CM, Odde DJ (June 2006). "Endothelium-mediated hepatocyte recruitment in the establishment of liver-like tissue in vitro". Tissue Engineering. 12 (6): 1627–1638. doi:10.1089/ten.2006.12.1627. PMID 16846358.
- ^ Yong E (August 28, 2013). "Lab-Grown Model Brains". The Scientist. Retrieved 26 December 2013.
- ^ أ ب ت ث ج Sato T, Vries RG, Snippert HJ, van de Wetering M, Barker N, Stange DE, van Es JH, Abo A, Kujala P, Peters PJ, Clevers H (May 2009). "Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche". Nature. 459 (7244): 262–265. Bibcode:2009Natur.459..262S. doi:10.1038/nature07935. PMID 19329995. S2CID 4373784.
- ^ أ ب Unbekandt M, Davies JA (March 2010). "Dissociation of embryonic kidneys followed by reaggregation allows the formation of renal tissues". Kidney International. 77 (5): 407–416. doi:10.1038/ki.2009.482. PMID 20016472.
- ^ Peng H, Poovaiah N, Forrester M, Cochran E, Wang Q (December 2014). "Ex Vivo Culture of Primary Intestinal Stem Cells in Collagen Gels and Foams". ACS Biomaterials Science & Engineering. 1 (1): 37–42. doi:10.1021/ab500041d. PMID 33435081.
- ^ Peng H, Wang C, Xu X, Yu C, Wang Q (January 2015). "An intestinal Trojan horse for gene delivery". Nanoscale. 7 (10): 4354–4360. doi:10.1039/c4nr06377e. PMID 25619169.
- ^ Lawrence ML, Chang CH, Davies JA (March 2015). "Transport of organic anions and cations in murine embryonic kidney development and in serially-reaggregated engineered kidneys". Scientific Reports. 5: 9092. Bibcode:2015NatSR...5E9092L. doi:10.1038/srep09092. PMC 4357899. PMID 25766625.
- ^ Xinaris C, Benedetti V, Rizzo P, Abbate M, Corna D, Azzollini N, Conti S, Unbekandt M, Davies JA, Morigi M, Benigni A, Remuzzi G (November 2012). "In vivo maturation of functional renal organoids formed from embryonic cell suspensions". Journal of the American Society of Nephrology. 23 (11): 1857–1868. doi:10.1681/ASN.2012050505. PMC 3482737. PMID 23085631.
- ^ Yui S, Nakamura T, Sato T, Nemoto Y, Mizutani T, Zheng X, Ichinose S, Nagaishi T, Okamoto R, Tsuchiya K, Clevers H, Watanabe M (March 2012). "Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5⁺ stem cell". Nature Medicine. 18 (4): 618–623. doi:10.1038/nm.2695. PMID 22406745.
- ^ أ ب ت Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME, Homfray T, Penninger JM, Jackson AP, Knoblich JA (September 2013). "Cerebral organoids model human brain development and microcephaly". Nature. 501 (7467): 373–379. Bibcode:2013Natur.501..373L. doi:10.1038/nature12517. PMC 3817409. PMID 23995685.
- ^ Huch M, Dorrell C, Boj SF, van Es JH, Li VS, van de Wetering M, Sato T, Hamer K, Sasaki N, Finegold MJ, Haft A, Vries RG, Grompe M, Clevers H (February 2013). "In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration". Nature. 494 (7436): 247–250. doi:10.1038/nature11826. PMC 3634804. PMID 23354049.
- ^ Shkumatov A, Baek K, Kong H (April 2014). "Matrix rigidity-modulated cardiovascular organoid formation from embryoid bodies". PLoS One. 9 (4): e94764. Bibcode:2014PLoSO...994764S. doi:10.1371/journal.pone.0094764. PMC 3986240. PMID 24732893.
- ^ Murry CE, Keller G (February 2008). "Differentiation of embryonic stem cells to clinically relevant populations: lessons from embryonic development". Cell. 132 (4): 661–680. doi:10.1016/j.cell.2008.02.008. PMID 18295582.
- ^ Choudhury D, Ashok A, Naing MW (March 2020). "Commercialization of Organoids". Trends in Molecular Medicine. 26 (3): 245–249. doi:10.1016/j.molmed.2019.12.002. PMID 31982341. S2CID 210922708.
- ^ Li ML, Aggeler J, Farson DA, Hatier C, Hassell J, Bissell MJ (January 1987). "Influence of a reconstituted basement membrane and its components on casein gene expression and secretion in mouse mammary epithelial cells". Proceedings of the National Academy of Sciences of the United States of America. 84 (1): 136–140. Bibcode:1987PNAS...84..136L. doi:10.1073/pnas.84.1.136. PMC 304157. PMID 3467345.
- ^ أ ب ت Pastuła A, Middelhoff M, Brandtner A, Tobiasch M, Höhl B, Nuber AH, Demir IE, Neupert S, Kollmann P, Mazzuoli-Weber G, Quante M (2016). "Three-Dimensional Gastrointestinal Organoid Culture in Combination with Nerves or Fibroblasts: A Method to Characterize the Gastrointestinal Stem Cell Niche". Stem Cells International. 2016: 3710836. doi:10.1155/2016/3710836. PMC 4677245. PMID 26697073.
- ^ Takahashi K, Yamanaka S (August 2006). "Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors". Cell. 126 (4): 663–676. doi:10.1016/j.cell.2006.07.024. hdl:2433/159777. PMID 16904174.
- ^ Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, Zhang F (November 2013). "Genome engineering using the CRISPR-Cas9 system". Nature Protocols. 8 (11): 2281–2308. doi:10.1038/nprot.2013.143. PMC 3969860. PMID 24157548.
- ^ Lavazza A, Massimini M (September 2018). "Cerebral organoids: ethical issues and consciousness assessment". Journal of Medical Ethics. 44 (9): 606–610. doi:10.1136/medethics-2017-104555. PMID 29491041.
- ^ Scully RP (6 July 2019). "Miniature brains grown in the lab have human-like neural activity". New Scientist. No. 3237.
- ^ Sample I (21 October 2019). "Scientists 'may have crossed ethical line' in growing human brains". The Guardian. p. 15.
- ^ Cai H, Ao Z, Tian C, et al. (2023). "Brain organoid reservoir computing for artificial intelligence". Nat Electron. 6 (12): 1032–1039. doi:10.1038/s41928-023-01069-w.
- ^ Smirnova L, Caffo BS, Gracias DH, Huang Q, Morales Pantoja IE, Tang B, Zack DJ, Berlinicke CA, Boyd JL, Harris TD, Johnson EC, Kagan BJ, Kahn J, Muotri AR, Paulhamus BL, Schwamborn JC, Plotkin J, Szalay AS, Vogelstein JT, Worley PF, Hartung T (2023). "Organoid intelligence (OI): the new frontier in biocomputing and intelligence-in-a-dish". Front Sci. 1: 1017235. doi:10.3389/fsci.2023.1017235.
- ^ Sato T, Stange DE, Ferrante M, Vries RG, Van Es JH, Van den Brink S, Van Houdt WJ, Pronk A, Van Gorp J, Siersema PD, Clevers H (November 2011). "Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium". Gastroenterology. 141 (5): 1762–1772. doi:10.1053/j.gastro.2011.07.050. PMID 21889923.
- ^ Jung P, Sato T, Merlos-Suárez A, Barriga FM, Iglesias M, Rossell D, Auer H, Gallardo M, Blasco MA, Sancho E, Clevers H, Batlle E (September 2011). "Isolation and in vitro expansion of human colonic stem cells". Nature Medicine. 17 (10): 1225–1227. doi:10.1038/nm.2470. PMID 21892181. S2CID 205388154.
- ^ Cai T, Qi Y, Jergens A, Wannemuehler M, Barrett TA, Wang Q (2018). "Effects of six common dietary nutrients on murine intestinal organoid growth". PLoS One. 13 (2): e0191517. doi:10.1371/journal.pone.0191517. PMC 5794098. PMID 29389993.
- ^ Qi Y, Lohman J, Bratlie KM, Peroutka-Bigus N, Bellaire B, Wannemuehler M, Yoon KJ, Barrett TA, Wang Q (September 2019). "Vitamin C and B3 as new biomaterials to alter intestinal stem cells". Journal of Biomedical Materials Research. Part A. 107 (9): 1886–1897. doi:10.1002/jbm.a.36715. PMC 6626554. PMID 31071241.
- ^ Davoudi Z, Peroutka-Bigus N, Bellaire B, Wannemuehler M, Barrett TA, Narasimhan B, Wang Q (April 2018). "Intestinal organoids containing poly(lactic-co-glycolic acid) nanoparticles for the treatment of inflammatory bowel diseases". Journal of Biomedical Materials Research. Part A. 106 (4): 876–886. doi:10.1002/jbm.a.36305. PMC 5826879. PMID 29226615.
- ^ Davoudi Z, Peroutka-Bigus N, Bellaire B, Jergens A, Wannemuehler M, Wang Q (May 2021). "Gut Organoid as a New Platform to Study Alginate and Chitosan Mediated PLGA Nanoparticles for Drug Delivery". Marine Drugs. 19 (5): 282. doi:10.3390/md19050282. PMC 8161322. PMID 34065505.
- ^ Qi Y, Shi E, Peroutka-Bigus N, Bellaire B, Wannemuehler M, Jergens A, Barrett T, Wu Y, Wang Q (May 2018). "Ex Vivo Study of Telluride Nanowires in Minigut". Journal of Biomedical Nanotechnology. 14 (5): 978–986. doi:10.1166/jbn.2018.2578. PMID 29883567.
- ^ Reding B, Carter P, Qi Y, Li Z, Wu Y, Wannemuehler M, Bratlie KM, Wang Q (April 2021). "Manipulate intestinal organoids with niobium carbide nanosheets". Journal of Biomedical Materials Research. Part A. 109 (4): 479–487. doi:10.1002/jbm.a.37032. PMID 32506610.
- ^ Zietek T, Giesbertz P, Ewers M, Reichart F, Weinmüller M, Urbauer E, Haller D, Demir IE, Ceyhan GO, Kessler H, Rath E (2020). "Organoids to Study Intestinal Nutrient Transport, Drug Uptake and Metabolism - Update to the Human Model and Expansion of Applications". Frontiers in Bioengineering and Biotechnology. 8: 577656. doi:10.3389/fbioe.2020.577656. PMC 7516017. PMID 33015026.
- ^ Zietek T, Rath E, Haller D, Daniel H (November 2015). "Intestinal organoids for assessing nutrient transport, sensing and incretin secretion". Scientific Reports. 5 (1): 16831. Bibcode:2015NatSR...516831Z. doi:10.1038/srep16831. PMC 4652176. PMID 26582215.
- ^ Rahmani S, Breyner NM, Su HM, Verdu EF, Didar TF (February 2019). "Intestinal organoids: A new paradigm for engineering intestinal epithelium in vitro". Biomaterials. 194: 195–214. doi:10.1016/j.biomaterials.2018.12.006. PMID 30612006. S2CID 58603850.
- ^ Sun L, Rollins D, Qi Y, Fredericks J, Mansell TJ, Jergens A, Phillips GJ, Wannemuehler M, Wang Q (December 2020). "TNFα regulates intestinal organoids from mice with both defined and conventional microbiota". International Journal of Biological Macromolecules. 164: 548–556. doi:10.1016/j.ijbiomac.2020.07.176. PMC 7657954. PMID 32693143.
- ^ Tong T, Qi Y, Rollins D, Bussiere LD, Dhar D, Miller CL, Yu C, Wang Q (December 2023). "Rational design of oral drugs targeting mucosa delivery with gut organoid platforms". Bioactive Materials. 30: 116–128. doi:10.1016/j.bioactmat.2023.07.014. PMC 10406959. PMID 37560199.
- ^ Davoudi Z, Atherly T, Borcherding DC, Jergens AE, Wannemuehler M, Barrett TA, Wang Q (December 2023). "Study Transportation of Drugs within Newly Established Murine Colon Organoid Systems". Advanced Biology. 7 (12): e2300103. doi:10.1002/adbi.202300103. PMC 10840714. PMID 37607116.
{{cite journal}}: CS1 maint: PMC embargo expired (link) - ^ Sakib S, Zou S (February 2024). "Attenuation of Chronic Inflammation in Intestinal Organoids with Graphene Oxide-Mediated Tumor Necrosis Factor-α_Small Interfering RNA Delivery". Langmuir. 40 (7): 3402–3413. doi:10.1021/acs.langmuir.3c02741. PMC 10883062. PMID 38325360.
- ^ Lindemans C, Mertelsmann A, Dudakov JA, Velardi E, Hua G, O'Connor M, Kolesnick R, van den Brink MR, Hanash AM (2014). "IL-22 Administration Protects Intestinal Stem Cells from Gvhd". Biology of Blood and Marrow Transplantation. 20 (2): S53–S54. doi:10.1016/j.bbmt.2013.12.056.
- ^ Zhang YG, Wu S, Xia Y, Sun J (September 2014). "Salmonella-infected crypt-derived intestinal organoid culture system for host-bacterial interactions". Physiological Reports. 2 (9): e12147. doi:10.14814/phy2.12147. PMC 4270227. PMID 25214524.
- ^ Geiser P, Di Martino ML, Samperio Ventayol P, Eriksson J, Sima E, Al-Saffar AK, Ahl D, Phillipson M, Webb DL, Sundbom M, Hellström PM, Sellin ME (January 2021). Sperandio V (ed.). "Salmonella enterica Serovar Typhimurium Exploits Cycling through Epithelial Cells To Colonize Human and Murine Enteroids". mBio. 12 (1). doi:10.1128/mBio.02684-20. PMC 7844539. PMID 33436434.
- ^ Dutta D, Heo I, O'Connor R (September 2019). "Studying Cryptosporidium Infection in 3D Tissue-derived Human Organoid Culture Systems by Microinjection". Journal of Visualized Experiments (151): 59610. doi:10.3791/59610. PMID 31566619. S2CID 203377662.
- ^ Co JY, Margalef-Català M, Li X, Mah AT, Kuo CJ, Monack DM, Amieva MR (February 2019). "Controlling Epithelial Polarity: A Human Enteroid Model for Host-Pathogen Interactions". Cell Reports. 26 (9): 2509–2520.e4. doi:10.1016/j.celrep.2019.01.108. PMC 6391775. PMID 30811997.
- ^ Tong T, Qi Y, Bussiere LD, Wannemuehler M, Miller CL, Wang Q, Yu C (August 2020). "Transport of artificial virus-like nanocarriers through intestinal monolayers via microfold cells". Nanoscale. 12 (30): 16339–16347. doi:10.1039/d0nr03680c. PMID 32725029.
- ^ أ ب Noel G, Baetz NW, Staab JF, Donowitz M, Kovbasnjuk O, Pasetti MF, Zachos NC (March 2017). "A primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions". Scientific Reports. 7 (1): 45270. Bibcode:2017NatSR...745270N. doi:10.1038/srep45270. PMC 5366908. PMID 28345602.
- ^ Bouchi R, Foo KS, Hua H, Tsuchiya K, Ohmura Y, Sandoval PR, Ratner LE, Egli D, Leibel RL, Accili D (June 2014). "FOXO1 inhibition yields functional insulin-producing cells in human gut organoid cultures". Nature Communications. 5: 4242. Bibcode:2014NatCo...5.4242B. doi:10.1038/ncomms5242. PMC 4083475. PMID 24979718.
- ^ Sontheimer-Phelps A, Chou DB, Tovaglieri A, Ferrante TC, Duckworth T, Fadel C, Frismantas V, Sutherland AD, Jalili-Firoozinezhad S, Kasendra M, Stas E, Weaver JC, Richmond CA, Levy O, Prantil-Baun R, Breault DT, Ingber DE (2020). "Human Colon-on-a-Chip Enables Continuous In Vitro Analysis of Colon Mucus Layer Accumulation and Physiology". Cellular and Molecular Gastroenterology and Hepatology. 9 (3): 507–526. doi:10.1016/j.jcmgh.2019.11.008. PMC 7036549. PMID 31778828.
- ^ Grassart A, Malardé V, Gobaa S, Sartori-Rupp A, Kerns J, Karalis K, Marteyn B, Sansonetti P, Sauvonnet N (September 2019). "Bioengineered Human Organ-on-Chip Reveals Intestinal Microenvironment and Mechanical Forces Impacting Shigella Infection". Cell Host & Microbe. 26 (3): 435–444.e4. doi:10.1016/j.chom.2019.08.007. PMID 31492657. S2CID 201868491.
- ^ أ ب ت McCracken KW, Catá EM, Crawford CM, Sinagoga KL, Schumacher M, Rockich BE, Tsai YH, Mayhew CN, Spence JR, Zavros Y, Wells JM (December 2014). "Modelling human development and disease in pluripotent stem-cell-derived gastric organoids". Nature. 516 (7531): 400–404. Bibcode:2014Natur.516..400M. doi:10.1038/nature13863. PMC 4270898. PMID 25363776.
- ^ Barker N, Huch M, Kujala P, van de Wetering M, Snippert HJ, van Es JH, Sato T, Stange DE, Begthel H, van den Born M, Danenberg E, van den Brink S, Korving J, Abo A, Peters PJ, Wright N, Poulsom R, Clevers H (January 2010). "Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro". Cell Stem Cell. 6 (1): 25–36. doi:10.1016/j.stem.2009.11.013. PMID 20085740.
- ^ Li X, Nadauld L, Ootani A, Corney DC, Pai RK, Gevaert O, Cantrell MA, Rack PG, Neal JT, Chan CW, Yeung T, Gong X, Yuan J, Wilhelmy J, Robine S, Attardi LD, Plevritis SK, Hung KE, Chen CZ, Ji HP, Kuo CJ (July 2014). "Oncogenic transformation of diverse gastrointestinal tissues in primary organoid culture". Nature Medicine. 20 (7): 769–777. doi:10.1038/nm.3585. PMC 4087144. PMID 24859528.
- ^ أ ب Nadauld LD, Garcia S, Natsoulis G, Bell JM, Miotke L, Hopmans ES, Xu H, Pai RK, Palm C, Regan JF, Chen H, Flaherty P, Ootani A, Zhang NR, Ford JM, Kuo CJ, Ji HP (August 2014). "Metastatic tumor evolution and organoid modeling implicate TGFBR2 as a cancer driver in diffuse gastric cancer". Genome Biology. 15 (8): 428. doi:10.1186/s13059-014-0428-9. PMC 4145231. PMID 25315765.
- ^ أ ب Hisha H, Tanaka T, Kanno S, Tokuyama Y, Komai Y, Ohe S, Yanai H, Omachi T, Ueno H (November 2013). "Establishment of a novel lingual organoid culture system: generation of organoids having mature keratinized epithelium from adult epithelial stem cells". Scientific Reports. 3: 3224. Bibcode:2013NatSR...3E3224H. doi:10.1038/srep03224. PMC 3828633. PMID 24232854.
- ^ أ ب Aihara E, Mahe MM, Schumacher MA, Matthis AL, Feng R, Ren W, Noah TK, Matsu-ura T, Moore SR, Hong CI, Zavros Y, Herness S, Shroyer NF, Iwatsuki K, Jiang P, Helmrath MA, Montrose MH (November 2015). "Characterization of stem/progenitor cell cycle using murine circumvallate papilla taste bud organoid". Scientific Reports. 5: 17185. Bibcode:2015NatSR...517185A. doi:10.1038/srep17185. PMC 4665766. PMID 26597788.
- ^ Ren W, Lewandowski BC, Watson J, Aihara E, Iwatsuki K, Bachmanov AA, Margolskee RF, Jiang P (November 2014). "Single Lgr5- or Lgr6-expressing taste stem/progenitor cells generate taste bud cells ex vivo". Proceedings of the National Academy of Sciences of the United States of America. 111 (46): 16401–16406. Bibcode:2014PNAS..11116401R. doi:10.1073/pnas.1409064111. PMC 4246268. PMID 25368147.
- ^ Hermans F, Hasevoets S, Vankelecom H, Bronckaers A, Lambrichts I (March 2024). "From Pluripotent Stem Cells to Organoids and Bioprinting: Recent Advances in Dental Epithelium and Ameloblast Models to Study Tooth Biology and Regeneration". Stem Cell Reviews and Reports. doi:10.1007/s12015-024-10702-w. PMC 11222197. PMID 38498295.
{{cite journal}}: Check|pmc=value (help); Check|pmid=value (help) - ^ Martin A, Barbesino G, Davies TF (1999). "T-cell receptors and autoimmune thyroid disease--signposts for T-cell-antigen driven diseases". International Reviews of Immunology. 18 (1–2): 111–140. doi:10.3109/08830189909043021. PMID 10614741.
- ^ Bredenkamp N, Ulyanchenko S, O'Neill KE, Manley NR, Vaidya HJ, Blackburn CC (September 2014). "An organized and functional thymus generated from FOXN1-reprogrammed fibroblasts". Nature Cell Biology. 16 (9): 902–908. doi:10.1038/ncb3023. PMC 4153409. PMID 25150981.
- ^ أ ب ت Vianello F, Poznansky MC (2007). "Generation of a tissue-engineered thymic organoid". Immunological Tolerance. Methods in Molecular Biology. Vol. 380. pp. 163–70. doi:10.1007/978-1-59745-395-0_9. ISBN 978-1-59745-395-0. PMID 17876092.
- ^ Sakib S, Uchida A, Valenzuela-Leon P, Yu Y, Valli-Pulaski H, Orwig K, Ungrin M, Dobrinski I (June 2019). "Formation of organotypic testicular organoids in microwell culture†". Biology of Reproduction. 100 (6): 1648–1660. doi:10.1093/biolre/ioz053. PMC 7302515. PMID 30927418.
- ^ Drost J, Karthaus WR, Gao D, Driehuis E, Sawyers CL, Chen Y, Clevers H (February 2016). "Organoid culture systems for prostate epithelial and cancer tissue". Nature Protocols. 11 (2): 347–358. doi:10.1038/nprot.2016.006. PMC 4793718. PMID 26797458.
- ^ Huch M, Gehart H, van Boxtel R, Hamer K, Blokzijl F, Verstegen MM, Ellis E, van Wenum M, Fuchs SA, de Ligt J, van de Wetering M, Sasaki N, Boers SJ, Kemperman H, de Jonge J, Ijzermans JN, Nieuwenhuis EE, Hoekstra R, Strom S, Vries RR, van der Laan LJ, Cuppen E, Clevers H (January 2015). "Long-term culture of genome-stable bipotent stem cells from adult human liver". Cell. 160 (1–2): 299–312. doi:10.1016/j.cell.2014.11.050. PMC 4313365. PMID 25533785.
- ^ Li P, Li Y, Wang Y, Liu J, Lavrijsen M, Li Y, Zhang R, Verstegen MM, Wang Y, Li TC, Ma Z, Kainov DE, Bruno MJ, de Man RA, van der Laan LJ, Peppelenbosch MP, Pan Q (January 2022). "Recapitulating hepatitis E virus-host interactions and facilitating antiviral drug discovery in human liver-derived organoids". Science Advances. 8 (3): eabj5908. Bibcode:2022SciA....8.5908L. doi:10.1126/sciadv.abj5908. hdl:11250/3047921. PMC 8769558. PMID 35044825. S2CID 246069868.
- ^ Huch M, Bonfanti P, Boj SF, Sato T, Loomans CJ, van de Wetering M, Sojoodi M, Li VS, Schuijers J, Gracanin A, Ringnalda F, Begthel H, Hamer K, Mulder J, van Es JH, de Koning E, Vries RG, Heimberg H, Clevers H (October 2013). "Unlimited in vitro expansion of adult bi-potent pancreas progenitors through the Lgr5/R-spondin axis". The EMBO Journal. 32 (20): 2708–2721. doi:10.1038/emboj.2013.204. PMC 3801438. PMID 24045232.
- ^ Hou S, Tiriac H, Sridharan BP, Scampavia L, Madoux F, Seldin J, Souza GR, Watson D, Tuveson D, Spicer TP (July 2018). "Advanced Development of Primary Pancreatic Organoid Tumor Models for High-Throughput Phenotypic Drug Screening". SLAS Discovery. 23 (6): 574–584. doi:10.1177/2472555218766842. PMC 6013403. PMID 29673279.
- ^ Wolff RA, Wang-Gillam A, Alvarez H, Tiriac H, Engle D, Hou S, Groff AF, San Lucas A, Bernard V, Allenson K, Castillo J, Kim D, Mulu F, Huang J, Stephens B, Wistuba II, Katz M, Varadhachary G, Park Y, Hicks J, Chinnaiyan A, Scampavia L, Spicer T, Gerhardinger C, Maitra A, Tuveson D, Rinn J, Lizee G, Yee C, Levine AJ (March 2018). "Dynamic changes during the treatment of pancreatic cancer". Oncotarget. 9 (19): 14764–14790. doi:10.18632/oncotarget.24483. PMC 5871077. PMID 29599906.
- ^ Below CR, Kelly J, Brown A, Humphries JD, Hutton C, Xu J, Lee BY, Cintas C, Zhang X, Hernandez-Gordillo V, Stockdale L, Goldsworthy MA, Geraghty J, Foster L, O'Reilly DA, Schedding B, Askari J, Burns J, Hodson N, Smith DL, Lally C, Ashton G, Knight D, Mironov A, Banyard A, Eble JA, Morton JP, Humphries MJ, Griffith LG, Jørgensen C (January 2022). "A microenvironment-inspired synthetic three-dimensional model for pancreatic ductal adenocarcinoma organoids". Nature Materials. 21 (1): 110–119. doi:10.1038/s41563-021-01085-1. PMC 7612137. PMID 34518665.
- ^ Barker N, van Es JH, Kuipers J, Kujala P, van den Born M, Cozijnsen M, Haegebarth A, Korving J, Begthel H, Peters PJ, Clevers H (October 2007). "Identification of stem cells in small intestine and colon by marker gene Lgr5". Nature. 449 (7165): 1003–1007. Bibcode:2007Natur.449.1003B. doi:10.1038/nature06196. PMID 17934449. S2CID 4349637.
- ^ Lee JH, Bhang DH, Beede A, Huang TL, Stripp BR, Bloch KD, Wagers AJ, Tseng YH, Ryeom S, Kim CF (January 2014). "Lung stem cell differentiation in mice directed by endothelial cells via a BMP4-NFATc1-thrombospondin-1 axis". Cell. 156 (3): 440–455. doi:10.1016/j.cell.2013.12.039. PMC 3951122. PMID 24485453.
- ^ Takasato M, Er PX, Chiu HS, Maier B, Baillie GJ, Ferguson C, Parton RG, Wolvetang EJ, Roost MS, Chuva de Sousa Lopes SM, Little MH (October 2015). "Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis". Nature. 526 (7574): 564–568. Bibcode:2015Natur.526..564T. doi:10.1038/nature15695. PMID 26444236. S2CID 4443766.
- ^ أ ب ت Freedman BS, Brooks CR, Lam AQ, Fu H, Morizane R, Agrawal V, Saad AF, Li MK, Hughes MR, Werff RV, Peters DT, Lu J, Baccei A, Siedlecki AM, Valerius MT, Musunuru K, McNagny KM, Steinman TI, Zhou J, Lerou PH, Bonventre JV (October 2015). "Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids". Nature Communications. 6: 8715. Bibcode:2015NatCo...6.8715F. doi:10.1038/ncomms9715. PMC 4620584. PMID 26493500.
- ^ Morizane R, Lam AQ, Freedman BS, Kishi S, Valerius MT, Bonventre JV (November 2015). "Nephron organoids derived from human pluripotent stem cells model kidney development and injury". Nature Biotechnology. 33 (11): 1193–1200. doi:10.1038/nbt.3392. PMC 4747858. PMID 26458176.
- ^ van den Brink SC, Baillie-Johnson P, Balayo T, Hadjantonakis AK, Nowotschin S, Turner DA, Martinez Arias A (November 2014). "Symmetry breaking, germ layer specification and axial organisation in aggregates of mouse embryonic stem cells". Development. 141 (22): 4231–4242. doi:10.1242/dev.113001. PMC 4302915. PMID 25371360.
- ^ Turner DA, Baillie-Johnson P, Martinez Arias A (February 2016). "Organoids and the genetically encoded self-assembly of embryonic stem cells". BioEssays. 38 (2): 181–191. doi:10.1002/bies.201500111. PMC 4737349. PMID 26666846.
- ^ Turner DA, Girgin M, Alonso-Crisostomo L, Trivedi V, Baillie-Johnson P, Glodowski CR, Hayward PC, Collignon J, Gustavsen C, Serup P, Steventon B, P Lutolf M, Arias AM (November 2017). "Anteroposterior polarity and elongation in the absence of extra-embryonic tissues and of spatially localised signalling in gastruloids: mammalian embryonic organoids". Development. 144 (21): 3894–3906. doi:10.1242/dev.150391. PMC 5702072. PMID 28951435.
- ^ أ ب Beccari L, Moris N, Girgin M, Turner DA, Baillie-Johnson P, Cossy AC, Lutolf MP, Duboule D, Arias AM (October 2018). "Multi-axial self-organization properties of mouse embryonic stem cells into gastruloids". Nature (in الإنجليزية). 562 (7726): 272–276. Bibcode:2018Natur.562..272B. doi:10.1038/s41586-018-0578-0. PMID 30283134. S2CID 52915553.
- ^ Rivron N (27 June 2018). "Blastoid: The backstory of the formation of blastocyst-like structure solely from stem cells". The Node. The Company of Biologists Ltd.
- ^ "Blastoid". Nicolas Rivron Lab. Netherlands.
- ^ Rivron NC, Frias-Aldeguer J, Vrij EJ, Boisset JC, Korving J, Vivié J, Truckenmüller RK, van Oudenaarden A, van Blitterswijk CA, Geijsen N (May 2018). "Blastocyst-like structures generated solely from stem cells". Nature. 557 (7703): 106–111. Bibcode:2018Natur.557..106R. doi:10.1038/s41586-018-0051-0. PMID 29720634. S2CID 13749109.
- ^ Rawlings TM, Makwana K, Tryfonos M, Lucas ES (July 2021). "Organoids to model the endometrium: implantation and beyond". Reproduction & Fertility. 2 (3): R85–R101. doi:10.1530/RAF-21-0023. PMC 8801025. PMID 35118399.
- ^ Lee EJ, Kim DE, Azeloglu EU, Costa KD (February 2008). "Engineered cardiac organoid chambers: toward a functional biological model ventricle". Tissue Engineering. Part A. 14 (2): 215–225. doi:10.1089/tea.2007.0351. PMID 18333774.
- ^ Molteni M (2018-06-27). "These Beating Mini-Hearts Could Save Big Bucks—And Maybe Lives". WIRED. Retrieved 2018-06-30.
- ^ Wiley LA, Burnight ER, DeLuca AP, Anfinson KR, Cranston CM, Kaalberg EE, Penticoff JA, Affatigato LM, Mullins RF, Stone EM, Tucker BA (July 2016). "cGMP production of patient-specific iPSCs and photoreceptor precursor cells to treat retinal degenerative blindness". Scientific Reports. 6: 30742. Bibcode:2016NatSR...630742W. doi:10.1038/srep30742. PMC 4965859. PMID 27471043.
- ^ Zilova L, Weinhardt V, Tavhelidse T, Schlagheck C, Thumberger T, Wittbrodt J (July 2021). Arias AM, Stainier DY (eds.). "Fish primary embryonic pluripotent cells assemble into retinal tissue mirroring in vivo early eye development". eLife. 10: e66998. doi:10.7554/eLife.66998. PMC 8275126. PMID 34252023.
- ^ Sachs N, de Ligt J, Kopper O, Gogola E, Bounova G, Weeber F, Balgobind AV, Wind K, Gracanin A, Begthel H, Korving J, van Boxtel R, Duarte AA, Lelieveld D, van Hoeck A, Ernst RF, Blokzijl F, Nijman IJ, Hoogstraat M, van de Ven M, Egan DA, Zinzalla V, Moll J, Boj SF, Voest EE, Wessels L, van Diest PJ, Rottenberg S, Vries RG, Cuppen E, Clevers H (January 2018). "A Living Biobank of Breast Cancer Organoids Captures Disease Heterogeneity". Cell. 172 (1–2): 373–386.e10. doi:10.1016/j.cell.2017.11.010. PMID 29224780.
- ^ van de Wetering M, Francies HE, Francis JM, Bounova G, Iorio F, Pronk A, van Houdt W, van Gorp J, Taylor-Weiner A, Kester L, McLaren-Douglas A, Blokker J, Jaksani S, Bartfeld S, Volckman R, van Sluis P, Li VS, Seepo S, Sekhar Pedamallu C, Cibulskis K, Carter SL, McKenna A, Lawrence MS, Lichtenstein L, Stewart C, Koster J, Versteeg R, van Oudenaarden A, Saez-Rodriguez J, Vries RG, Getz G, Wessels L, Stratton MR, McDermott U, Meyerson M, Garnett MJ, Clevers H (May 2015). "Prospective derivation of a living organoid biobank of colorectal cancer patients". Cell. 161 (4): 933–945. doi:10.1016/j.cell.2015.03.053. PMC 6428276. PMID 25957691.
- ^ Quereda V, Hou S, Madoux F, Scampavia L, Spicer TP, Duckett D (September 2018). "A Cytotoxic Three-Dimensional-Spheroid, High-Throughput Assay Using Patient-Derived Glioma Stem Cells". SLAS Discovery. 23 (8): 842–849. doi:10.1177/2472555218775055. PMC 6102052. PMID 29750582.
- ^ Dayton TL, Alcala N, Moonen L, den Hartigh L, Geurts V, Mangiante L, Lap L, Dost AF, Beumer J, Levy S, van Leeuwaarde RS, Hackeng WM, Samsom K, Voegele C, Sexton-Oates A, Begthel H, Korving J, Hillen L, Brosens LA, Lantuejoul S, Jaksani S, Kok NF, Hartemink KJ, Klomp HM, Borel Rinkes IH, Dingemans AM, Valk GD, Vriens MR, Buikhuisen W, van den Berg J, Tesselaar M, Derks J, Speel EJ, Foll M, Fernández-Cuesta L, Clevers H (December 2023). "Druggable growth dependencies and tumor evolution analysis in patient-derived organoids of neuroendocrine neoplasms from multiple body sites". Cancer Cell. 41 (12): 2083–2099.e9. doi:10.1016/j.ccell.2023.11.007. PMID 38086335.
- ^ Zidarič T, Gradišnik L, Velnar T (September 2022). "Astrocytes and human artificial blood-brain barrier models". Bosnian Journal of Basic Medical Sciences. 22 (5): 651–672. doi:10.17305/bjbms.2021.6943. PMC 9519155. PMID 35366791.
- ^ Zietek T, Rath E, Haller D, Daniel H (November 2015). "Intestinal organoids for assessing nutrient transport, sensing and incretin secretion". Scientific Reports. 5: 16831. Bibcode:2015NatSR...516831Z. doi:10.1038/srep16831. PMC 4652176. PMID 26582215.
- ^ أ ب ت Cruz NM, Song X, Czerniecki SM, Gulieva RE, Churchill AJ, Kim YK, Winston K, Tran LM, Diaz MA, Fu H, Finn LS, Pei Y, Himmelfarb J, Freedman BS (November 2017). "Organoid cystogenesis reveals a critical role of microenvironment in human polycystic kidney disease". Nature Materials. 16 (11): 1112–1119. Bibcode:2017NatMa..16.1112C. doi:10.1038/nmat4994. PMC 5936694. PMID 28967916.
- ^ أ ب ت Kim YK, Refaeli I, Brooks CR, Jing P, Gulieva RE, Hughes MR, Cruz NM, Liu Y, Churchill AJ, Wang Y, Fu H, Pippin JW, Lin LY, Shankland SJ, Vogl AW, McNagny KM, Freedman BS (December 2017). "Gene-Edited Human Kidney Organoids Reveal Mechanisms of Disease in Podocyte Development". Stem Cells. 35 (12): 2366–2378. doi:10.1002/stem.2707. PMC 5742857. PMID 28905451.
- ^ Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S (November 2007). "Induction of pluripotent stem cells from adult human fibroblasts by defined factors". Cell. 131 (5): 861–872. doi:10.1016/j.cell.2007.11.019. hdl:2433/49782. PMID 18035408. S2CID 8531539.
- ^ أ ب ت Hsieh WC, Ramadesikan S, Fekete D, Aguilar RC (2018-02-14). "Kidney-differentiated cells derived from Lowe Syndrome patient's iPSCs show ciliogenesis defects and Six2 retention at the Golgi complex". PLoS One. 13 (2): e0192635. Bibcode:2018PLoSO..1392635H. doi:10.1371/journal.pone.0192635. PMC 5812626. PMID 29444177.
- ^ Howden SE, Thomson JA, Little MH (May 2018). "Simultaneous reprogramming and gene editing of human fibroblasts". Nature Protocols. 13 (5): 875–898. doi:10.1038/nprot.2018.007. PMC 5997775. PMID 29622803.
- ^ أ ب ت ث Forbes TA, Howden SE, Lawlor K, Phipson B, Maksimovic J, Hale L, Wilson S, Quinlan C, Ho G, Holman K, Bennetts B, Crawford J, Trnka P, Oshlack A, Patel C, Mallett A, Simons C, Little MH (May 2018). "Patient-iPSC-Derived Kidney Organoids Show Functional Validation of a Ciliopathic Renal Phenotype and Reveal Underlying Pathogenetic Mechanisms". American Journal of Human Genetics. 102 (5): 816–831. doi:10.1016/j.ajhg.2018.03.014. PMC 5986969. PMID 29706353.
- ^ أ ب Tanigawa S, Islam M, Sharmin S, Naganuma H, Yoshimura Y, Haque F, Era T, Nakazato H, Nakanishi K, Sakuma T, Yamamoto T, Kurihara H, Taguchi A, Nishinakamura R (September 2018). "Organoids from Nephrotic Disease-Derived iPSCs Identify Impaired NEPHRIN Localization and Slit Diaphragm Formation in Kidney Podocytes". Stem Cell Reports. 11 (3): 727–740. doi:10.1016/j.stemcr.2018.08.003. PMC 6135868. PMID 30174315.
- ^ Engle SJ, Blaha L, Kleiman RJ (November 2018). "Best Practices for Translational Disease Modeling Using Human iPSC-Derived Neurons". Neuron. 100 (4): 783–797. doi:10.1016/j.neuron.2018.10.033. PMID 30465765.
- ^ Rath E, Chamaillard M (eds.). "Metabolites". Special Issue of the Metabolites Journal. Retrieved 2022-10-16.
- ^ أ ب Dekkers JF, Wiegerinck CL, de Jonge HR, Bronsveld I, Janssens HM, de Winter-de Groot KM, Brandsma AM, de Jong NW, Bijvelds MJ, Scholte BJ, Nieuwenhuis EE, van den Brink S, Clevers H, van der Ent CK, Middendorp S, Beekman JM (July 2013). "A functional CFTR assay using primary cystic fibrosis intestinal organoids". Nature Medicine. 19 (7): 939–945. doi:10.1038/nm.3201. PMID 23727931. S2CID 5369669.
- ^ أ ب Dekkers JF, Berkers G, Kruisselbrink E, Vonk A, de Jonge HR, Janssens HM, Bronsveld I, van de Graaf EA, Nieuwenhuis EE, Houwen RH, Vleggaar FP, Escher JC, de Rijke YB, Majoor CJ, Heijerman HG, de Winter-de Groot KM, Clevers H, van der Ent CK, Beekman JM (June 2016). "Characterizing responses to CFTR-modulating drugs using rectal organoids derived from subjects with cystic fibrosis". Science Translational Medicine. 8 (344): 344ra84. doi:10.1126/scitranslmed.aad8278. PMID 27334259. S2CID 19462535.
- ^ Schwank G, Koo BK, Sasselli V, Dekkers JF, Heo I, Demircan T, Sasaki N, Boymans S, Cuppen E, van der Ent CK, Nieuwenhuis EE, Beekman JM, Clevers H (December 2013). "Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients". Cell Stem Cell. 13 (6): 653–658. doi:10.1016/j.stem.2013.11.002. PMID 24315439.
- ^ Zhang FL, Hu Z, Wang YF, Zhang WJ, Zhou BW, Sun QS, Lin ZB, Liu KX (October 2023). "Organoids transplantation attenuates intestinal ischemia/reperfusion injury in mice through L-Malic acid-mediated M2 macrophage polarization". Nature Communications. 14 (1): 6779. doi:10.1038/s41467-023-42502-0. PMC 10600233. PMID 37880227.
- ^ "World's first mini organ transportation to a patient with ulcerative colitis". Tokyo Medical and Dental University via medicalxpress.com. Retrieved 18 September 2022.
- ^ Watanabe S, Kobayashi S, Ogasawara N, Okamoto R, Nakamura T, Watanabe M, Jensen KB, Yui S (March 2022). "Transplantation of intestinal organoids into a mouse model of colitis". Nature Protocols. 17 (3): 649–671. doi:10.1038/s41596-021-00658-3. PMID 35110738. S2CID 246488596.
- ^ أ ب ت ث ج Ader M, Tanaka EM (December 2014). "Modeling human development in 3D culture". Current Opinion in Cell Biology. 31: 23–28. doi:10.1016/j.ceb.2014.06.013. PMID 25033469.
- ^ Martinez-Morales JR, Cavodeassi F, Bovolenta P (2017). "Coordinated Morphogenetic Mechanisms Shape the Vertebrate Eye". Frontiers in Neuroscience. 11: 721. doi:10.3389/fnins.2017.00721. PMC 5742352. PMID 29326547.
- ^ Gordon A, Yoon SJ, Tran SS, Makinson CD, Park JY, Andersen J, Valencia AM, Horvath S, Xiao X, Huguenard JR, Pașca SP, Geschwind DH (March 2021). "Long-term maturation of human cortical organoids matches key early postnatal transitions". Nature Neuroscience. 24 (3): 331–342. doi:10.1038/s41593-021-00802-y. PMC 8109149. PMID 33619405.
قراءات إضافية
- Chi KR (September 2015). "Orchestrating Organoids. A guide to crafting tissues in a dish that reprise in vivo organs". The Scientist.
- Takebe T, Enomura M, Yoshizawa E, Kimura M, Koike H, Ueno Y, Matsuzaki T, Yamazaki T, Toyohara T, Osafune K, Nakauchi H, Yoshikawa HY, Taniguchi H (May 2015). "Vascularized and Complex Organ Buds from Diverse Tissues via Mesenchymal Cell-Driven Condensation". Cell Stem Cell. 16 (5): 556–565. doi:10.1016/j.stem.2015.03.004. PMID 25891906.
- Turner DA, Baillie-Johnson P, Martinez Arias A (February 2016). "Organoids and the genetically encoded self-assembly of embryonic stem cells". BioEssays. 38 (2): 181–191. doi:10.1002/bies.201500111. PMC 4737349. PMID 26666846.
- Willyard C (July 2015). "The boom in mini stomachs, brains, breasts, kidneys and more". Nature. 523 (7562): 520–522. Bibcode:2015Natur.523..520W. doi:10.1038/523520a. PMID 26223610.
وصلات خارجية
- "Organoid-based regenerative medicine". Longevity Wiki. 30 March 2024.