نحاس
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
النحاس يرمز له (نح) فلزCopper يرمز له بـ (Cu) عدده الذري 29, ووزنه الذري 63,54 ، كثافته 8,95 ، ونقطة أنصهاره 1083 درجة مئوية, ونقطة غليانه 2310 درجة مئوية, وتكافؤه 1و2.
يوجد في الطبيعة بصورة منفردة او متحدة على شكل أكاسيد, ينقى بالتحليل الكهربائي، والنحاس مادة لينة القوام قابلة للطرق تتفاعل مع الجو مكونة نوع من الصدأ يعرف بأوكسيد النحاس لونها أخضر وهي مادة سامة, والنحاس عموما بطئ التفاعل مع الحوامض المخففة.
يعتبر النحاس من اقدم المعادن التي اكتشفها الانسان القديم و طوعا لاستخداماته المختلفة.
النحاس مادة جيدة للتوصيل الحراري والتوصيل الكهربائي, لذا تصنع منه المبادلات الحرارية والاسلاك والتوصيلات الكهربائية, كذلك يستخدم النحاس في صنع البطاريات والعدات الكهربائية والصناعية وأوعية الطهي.
يدخل النحاس في تركيب العديد من السبائك حيث يضاف مثلا للذهب بكميات قليلة لاعطاء الذهب الصلادة الكافية في تصنيع المخشلات, وتصنع منه العملات المعدنية كعملة نحاسية أو يدخل ضمن السبائك, يدخل في صناعة البرونز (سبيكة), وكذلك قي صناعة الأعتدة الحربية, وبعض الأجهزة والمعدات الموسيقية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الوصف
معدن ذو لون أصفر ضارب إلى الحمرة, وهو يقع في الفصيلة IB (أو الفصيلة 11) في الجدول الدوري. وتشمل هذه الفصيلة معدني الفضة والذهب إضافة إلى النحاس[الجدول الدوري]؛ تحوي ذرته في طبقتها الإلكترونية الخارجية إلكتروناً S واحداً مع إشباع المدارات d في الطبقة الداخلية، فيكون أحادي التكافؤ، مثل عناصر الفصيلة IA إلا أن إلكتروناً من الطبقة d ما قبل الأخيرة يصبح إلكترون تكافؤ لتقارب سويات طاقة الإلكترونات d والإلكترونات الخارجية S، فيأخذ النحاس إضافة إلى درجة الأكسدة +1 درجة الأكسدة +2 وهي درجة الأكسدة الأثبت، وتصبح عندئذ الطبقة الداخلية فيه غير مكتملة، ويدخل في عداد المعادن الانتقالية[[[ر:]] المعدن].
تاريخ إستعمال النحاس
استُحصِل النحاس منذ عصور ما قبل التاريخ، ومن المحتمل أن يكون من بين أول العناصر التي استخدمها الإنسان، ويعود ذلك لعدّة أسباب:
ـ وجوده حراً ونقياً في الطبيعة.
ـ الألوان البراقة والمميزة لفلزات النحاس التي لا يمكن تجاهلها، ويسهل تعرّفها.
ـ سهولة إرجاع فلزاته إلى معدن النحاس.
ـ وجوده في بقاع كثيرة من الأرض.
ـ ليّن يمكن بسهولة تشكيله لأغراض منزلية أو لصناعة الحلي.
ـ استعمل الإنسان القديم البرونز bronze وهو سبيكة (خليطة) قصدير ونحاس.
وكان النحاس أول معدن يلين لإستخدام الإنسان فيما نعلم ؛ فنجده في مسكن من مساكن البحيرة عند روبتهاوزن في سويسره ، ويرجع ذلك إلى سنة 6000 ق.م تقريباً. ونجده أيضاً في أرض الجزيرة بين دجلة والفرات من عهد ما قبل التاريخ ، ويرجع إلى سنة 4500 ق.م تقريبا ؛ ثم نجده في مقابر البداري في مصر ، ويرجع عهده إلى ما يقرب من سنة 4000 ق.م ، ونجده كذلك في آثار أور التي ترجع إلى سنة 3100 قبل الميلاد تقريباً ، وفي آثار بناة الجبال في أمريكا الشمالية ، التي ترجع إلى عصر لا نستطيع تحديده. وليست تقع بداية عصر المعادن عند تأريخ إكتشافها بل يبدأ ذلك العصر بتحوير المعادن بواسطة النار والطَّرق بحيث تلائم غايات الإنسان ؛ ويعتقد علماء المعادن أن أول إستعدان للنحاس من مناجمه الحجرية جاء بفعل المصادفة حين أذابت نارُ أوقدها الناس ليستدفئوا، نحاساً كان لاصقا بالأحجار التي أحاطوا بها النار ؛ ولقد لوحظت أمثال هذه المصادفة مراراً في اجتماعات البدائيين حول نارهم في عصرنا هذا؛ ومن الجائز أن تكون هذه الحادثة العابرة هي التي أدت بالإنسان الأول في نهاية الأمر- بعد تكرارها مرات كثيرة- ذلك الإنسان الذي لبث أمداً طويلا لا يساوره القلق في إستعمال الحجر الأصم الصليب ، أن يجعل من هذه المادة المرنة عنصراً يتخذ منه آلاته وأسلحته ، لأنها أيسر من الحجر صياغة وأدوم بقاء ؛ والأغلب أن يكون المعدن قد أستعمل بادئ ذي بدء بالصورة التي قدمته عليها يد الطبيعة ، وإنها لَيَدٌ فيها سخاء وبها إهمال في آن واحد؛ فكان نقيا حينا، مشوبا في معظم الأحيان ثم حدث بعد ذلك بزمن طويل- وربما كان ذلك حول سنة 3500 ق.م- في المنطقة التي تحيط بالطرف الشرقي من البحر الأبيض المتوسط ، أن وقع الناس على فن صهر المعادن وإستخراجها من مناجمها؛ ثم بدءوا في صبهّا نحو سنة 1500 ق.م "كما تدل على ذلك النقوش البارزة في مقبرة رخ- مارا في مصر)؛ فكانوا يصبّون النحاس المصهور في إناء من الطين أو الرمل ، ثم يتركونه يبرد على صورة يريدونها ، مثل رأس الرمح أو الفأس ؛ فلما أن كشف الإنسان عن هذه العملية في النحاس ، استخدمها في مجموعة منوَّعة من المعادن الأخرى ؛ وبهذا توفر للإنسان من العناصر القوية ما إستطاع به أن يبني أعظم ما يعرف من ضروب الصناعة ، وتهيأ له الطريق إلى غزو الأرض والبحر والهواء؛ ومن الجائز أن تكون كثرة النحاس في شرقي البحر الأبيض المتوسط هي التي سبَّبَت قيام ثقافات جديدة قوية في الألف الرابع من السنين قبل الميلاد ، في عيلام وما بين النهرين ومصر ، ثم إمتدت من هاتيك الأصقاع إلى سائر أجزاء المعمورة فبدّلتها حالا بعد حال.
جاء العصر البرونزي بعد العصر الحجري. واستخدم المصريون القدماء مركّبات النحاس لتلوين الزجاج منذ 15000 عام قبل الميلاد، ومن المعتقد أنهم أول من استخلص النحاس منذ خمسة آلاف سنة على الأقل. فقد وجد بالتحليل أن الآنية القديمة التي صنعوها كانت من النحاس الخالص، وليس من سبائكه. وفي عام 400 ق.م انتقلت هذه المعلومات إلى أوربا وخاصة في منطقة سوانزي جنوب مقاطعة ويلز بالمملكة المتحدة.
غير أن النحاس وحده ليّن ، فهو على الرغم من شدة صلاحيته للتشكيل مما ينفع في تحقيق طائفة من أغراضنا "ماذا كان يصنع عصرنا الكهربائي بغير نحاس؟" إلا أنه أضعف من أن يحتمل مهام السلم والحرب التي تتطلب معدنا أقوى ؛ لهذا كان لابد من عنصر آخر يضاف إلى النحاس ليشدّ من صلابته ؛ ورغم أن الطبيعة قد أشارت إلى الإنسان بما عسى أن يضيفه إلى النحاس لهذه الغاية من مواد كثيرة الأنواع ، بل إن الطبيعة كثيراً ما قدمت له نحاسا تم بالفعل خلطه وإشتدت صلابته بما فيه من قصدير وزنك ، مكونّةً بذلك برونزاً طبيعيا أو نحاسا أصفر ، على رغم هذه المعونة من الطبيعة ، فقد لبث الإنسان- فيما نظن- قرونا قبل أن يخطو الخطوة الثانية في هذا الصدد ؛ وأعني بها خلط معدن بمعدن خلطا مدبرَّا مقصودا للحصول على مركبات أصلح لأغراضه.
الأهمية الغذائية للنحاس
يحتوي الجسم على كمية من النحاس لا تقل عن 100 ملجم؛ تساعد في الوقاية من فقر الدم المعروف بالأنيميا ، كما يدخل في تركيب بعض الأنزيمات ، ونقصه يؤدي إلى اضطراب النمو ، وفقر الدم ويمكن الحصول عليه من اللحوم وصفار البيض والفواكه والخضار.
الاستخدامات الصناعية للنحاس ومركباته
من استخدامات النحاس المهمة صناعة أسلاك الكهرباء إذ يستهلك حوالي 40% من النحاس المنتج في العالم سنوياً في هذا المجال ، ونظراً لارتفاع الحرارة النوعية للنحاس فإنه يستعمل كوسيط لنقل الحرارة في عمليات التسخين والتبريد.
سبائك النحاس

يدخل النحاس في صناعة أنواع متعددة جداً من السبائك منها ما يلي:
- النحاس الأصفر (Brass): وهو سبيكة من النحاس والخارصين أو يسمى الزنك ، والنحاس الأصفر مقاوم للعوامل الجوية والمواد الكميائية ويمكن صبه وتلميعه، كما أن له ألواناً تتراوح من الأحمر إلى الأصفر إلى الأبيض حسب نسبة الخارصين فيه ، ويستخدم في التوصيلات الكهربائية وفي صنع السخانات والغلايات.
- البرونز ( Bronze ): وهو سبيكة من النحاس والقصدير ، ويتميز بأنه مقاوم للمواد الكميائية وشديد الصلابة، وتتكون بإضافة القصدير بنسبة 40% مما يجعلها تتصف بالمرونة.
هناك سبائك نحاسية كثيرة يختلف تركيبها باختلاف الوظائف التي تصنع لتأديتها والتي تختلف خصائصها حسب العناصر المكونة للسبيكة.
الانتاج
يتم تنقيب 10 ملايين طن متري من النحاس تقريبًا كّل عام في كل أنحاء العالم. وفي كل قارة مناجم (ترسبات) نحاس. وأغلب النحاس العالمي يأتي من سلسلة الجبال الممتدة من ألاسكا إلى طرف أمريكا الجنوبية. وفي بعض الأماكن، يستخرج عمال المناجم خام النحاس من مناجم بعيدة عن سطح الأرض، وفي أماكن أخرى، يزيحونه من حفر كبيرة مكشوفة على السطح. وفي التعدين المكشوف تزيح الجرافات الضخمة أو آلات أخرى الخام من "درجات" واسعة، ترتفع إلى 12 أو 21 مترًا. وتعدُّ تشيلي أكبر دولة منتجة للنحاس في العالم، حيث المناجم الضخمة بالقرب من سانتياجو وفي صحراء أتاكاما، تمثل المصدر لأغلب الناتج الوطني الإجمالي. وتنتج تشيلي نحو ربع إنتاج العالم من النحاس. وتأتي الولايات المتحدة في المرتبة الثانية حيث تنتج نحو خمس إنتاج العالم من النحاس. ويأتي ثلثا الناتج للولايات المتحدة من أريزونا. وتستورد الولايات المتحدة النحاس إذ إنها تستهلك من النحاس أكثر مما تنتجه. وتأتي كندا في المرتبة الثالثة من حيث الإنتاج، حيث تنتج أقل من عُشْر إنتاج العالم من النحاس. ويأتي أغلب نحاسها من كولومبيا البريطانية، وأونتاريو.
وتعتبر بيرو وبولندا وزامبيا من أهم منتجي النحاس. وتوجد ترسبات هائلة من خام النحاس في أستراليا والصين والمكسيك والكونغو الديمقراطية (زائير سابقًا).
In 2005, Chile was the top mine producer of copper with at least one-third world share followed by the USA, Indonesia and Peru, reports the British Geological Survey.
الحصول على النحاس من الخام
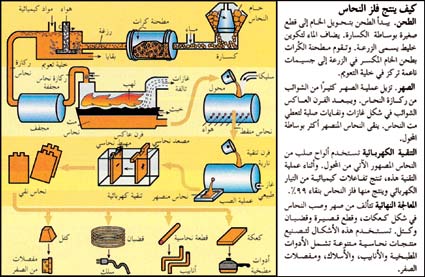
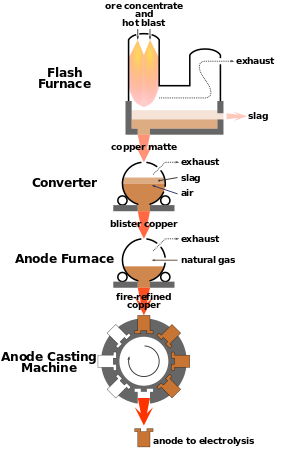
يتم استخلاص النحاس من خاماته بالطرق الحرارية كما هو موضح في شكل 12، ويتم ذلك على مراحل: تركيز معادن النحاس الموجودة في الخامة، والتحميص إن كانت له ضرورة، والصهارة (الصهر) إلى مخلوط كبريتيدى، ثم تحويل المخلوط الكبريتيدى إلى نحاس مُبَثَّر. وينقى النحاس المبثر زيادة على ذلك لإنتاج الرُتَب التجارية. وقد استدعت معدلات الإنتاج المتزايدة استخدام درجات حرارة تشغيل أعلى، وصاحب ذلك ارتفاع في فاعلية التفاعلات الكيميائية، وكبر أحجام الفلز والخبث والغازات الناتجة.[6]
في موقع المنجم، تحمل الجرافات خام النحاس غالبا في شكل صخور جلمودية كبيرة في الشاحنات، وعربات السكة الحديدية. وتحمل هذه الناقلات الخام إلى المطاحن، أو المصاهر. ولايعامل كل الخام بالطرق نفسها؛ فهناك اختلافات تعتمد على نوعية الخام. وعلى كل حال، فإن طرق استخلاص النحاس قد صممت لفصل مواد المعادن النفيسة من الخام، ونفايات الصخور، ولاستخلاص النحاس، وأي فلزات أخرى قد توجد في الخليط الناتج، وكذلك لتنقية الفلزات المنتجة. والطريقة المتبعة أن يرسل الخام إلى المطحنة، حيث تفتت وتزال النفايات الصخرية، وترسل المواد الناتجة إلى المصهر، حيث يفصل النحاس الفلزي الذي قد يحتوي على فلزات أخرى، مثل الذهب، والفضة والنيكل التي يجب أن تزال بالتنقية.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الطحن
يـبدأ الطحن في الكسارة حيث يجرش الخام إلى قطع صغيرة، ثم يضاف الماء إلى الخام المجروش ليكون خليطاً شبيهاً بالحساء يسمى رزغة. وتمرر الرزغة في مطاحن الكرات وهي أسطوانات في شكل براميل دوارة ممتلئة إلى نصف سعتها بكرات حديدية. وأثناء دوران الأسطوانات، فإن الكرات تجرش الخام إلى جسيمات بحجم صغير كاف لتمريرها من خلال غربال به 1,600 فتحة لكل سم². وتعرض الرزغة بعد ذلك لعملية التعويم التي تقوم بتركيز الجسيمات الحاملة للمادة المعدنية. وتمر الرزغة أولاً في حاويات تسمى خلايا التعويم وهناك تضاف الكيميائيات والزيت ويحرك الخليط كله بوساطة مجاديف أو بالهواء المنبثق من خراطيم ضيقة لتجعله مثيراً للفقاقيع. وأحد الكيميائيات يثبت الفقاقيع، بينما تغطي مادة كيميائية أخرى جسيمات المعدن، بحيث تمكنها من الالتصاق بالفقاقيع. وتطفو الفقاقيع مع جسيمات المعدن إلى سطح الخلية مكونة رغوة. ثم تقشط هذه الرغوة، وتجفف ويسمى الناتج بركازة النحاس، وربما تحتوي ما بين 15 و33% من وزنها نحاسًا. أما النفايات، وتسمى بقايا، فلا تلتصق بالفقاقيع وتفرغ من الجزء الأسفل للخلية.
الصهر
يزيل الصهر أغلب الشوائب المتبقية بعيداً عن النحاس. في عملية الصهر، تذهب ركازة النحاس (في وجود الهواء والأكسجين النقي) أولاً خلال فرن عاكس. وهذا النوع من الأفران قد يعالج ما مقداره 2700 طن متري من خلاصة النحاس في اليوم. وتسلط حجرة وقود في طرف الفرن اللهب على الخلاصة لتحولها إلى كتلة تغلي. وتساعد الحرارة في التخلص من بعض الشوائب في شكل غاز ثاني أكسيد الكبريت وتترسب المادة المنصهرة في قاع الفرن. أما الشوائب الأخرى فترتفع إلى أعلى هذه الكتلة المنصهرة، مكونة خبثاً يتألف أساساً من أكسيد الحديد والسليكا ثم يقشط الخبث ويتخلص منه. أما الخليط الجديد المسمى المت فيحتوي على 50 إلى 75% نحاسًا. ويظل محتوياً على شوائب في شكل كبريتيد الحديد وفلزات أخرى.
ويؤخذ المت في المرحلة الثانية إلى محول، حيث تعمل مضخات على ضغط الهواء خلال المت المنصهر، وتضاف السليكا التي تأتلف مع الشوائب لتكوّن خبثاً. هذا الخبث يقشط من الطبقة العليا، ويسمى الخليط الجديد نحاسًا منفطًا، وذلك بسبب أن سطح النحاس يتنفط أثناء تبريده. ويحتوي هذا النحاس على 97 إلى 99,5% من النحاس النقي.
وتتم تنقية النحاس المنفط في فرن تنقية. وهذا الفرن يزيل أغلب الشوائب المتبقية وخاصة الأكسجين. وفي العملية المسماة بالتنقية بالصُّعد أو الإرجاع، فإن غازات طبيعية تدفع إلى داخل الفرن المحتوي على النحاس المنصهر. وعندما تحترق الغازات الطبيعية ينزع الأكسجين والغازات الأخرى من النحاس الناتج عن هذه العملية فيكون بنقاوة 99,9%.
أما الأفران العاكسة المستخدمة في صهارة خامات النحاس فيصل طولها ~ 30 م وتتفاوت في عرضها من 7,5 إلى 10,5 م. وتتكون شحنتها في العموم من رُكُزات محمصة أو غير محمصة، ويضاف إليها على فترات خبث منصهر من المحول ويضاف أيضاً صهور مناسب. والوقود المستخدم قد يكون غاز طبيعى أو زيت أو فحم مسحوق حسب المتاح والتكلفة. تتراوح درجة الحرارة ما بين 1480 و1650 ْم في منطقة الصهر، وعلى الأقل ما بين 1090 و1260 ْم في موضع القشد. والناتج من الفرن هو مخلوط النحاس الكبريتيدى، الذى يتكون في أكثره من كبريتيد نحاسوز به نسب كبيرة من كبريتيد الحديدوز، وبه نسب أقل من كبريتيدات أخرى. وفى وقت من الأوقات استخدم طوب السليكا للتبطين، واستبعدت تقريباً كل الحراريات الأخرى في البناء بأكمله، شاملاً سقوف العَقْد الكَتِفِى للفرن. وقد أدت معدلات الإنتاج العالية إلى تزايد الظروف القاسية على الحراريات، وأدى ذلك إلى الاستخدام المتزايد للطوب القاعدى لكامل بناء الفرن.
ويستخدم أسلوب العُقَد المعلقة للسقوف المبنية من الطوب القاعدى. وفى درجة حرارة تشغيل الفرن، يتأكسد الفلز عند النهايات المتعرضة للهواء، ويتحد مع المغنسيا الموجودة في الطوب مكوناً رابطة مغنسية فرايتية. وعندما تشحن رُكَازات رطبة إلى داخل الفرن فإنها تسبب تصدع أو تَمَيُّه للطوب القاعدى حول الفجوات والعيوب، فإن ذلك يستدعى استخدام طوب حرارى لا يتميه بسبب الرطوبة مثل الطوب عالى الألومينا. وتبنى جدران الفرن الأعلى من خط الخبث كاملة من طوب المغنسيا. أما الجدران تحت خط الخبث فتبنى من طوب قاعدى محروق (مُكَلّس)، مُدعَّم من الخلف بطوب طين حرارى. وتتكون بطانة قاع الفرن عادة من خليط دَّك من المغنسيا، مدعم من الخلف بطوب طين حرارى أو طوب قاعدى.
وفى المحول يتم تحويل المخلوط الكبريتيدى الخارج من الفرن العاكس، الذى يحتوى على 20-50% نحاس، إلى نحاس مَُبَثَّر نقاوته من 96 إلى 99%. تتكون شحنة المحول من المخلوط الكبريتيدى، وصهور سليكى أو أى صهور آخر حسب الحاجة، وتشحن في بعض الأحيان رُكازات خام أو خردة نحاس. وأثناء عملية التحويل يدفع هواء من خلال فتحات في المحول تسمى القصبات فيمر مباشرة خلال الشحنة المنصهرة. والخبث المتكون خلال هذه العملية يتكون من أكسيد حديد وسليكا بالإضافة إلى نسبة قليلة من النحاس. يعاد هذا الخبث مرة أخرى إلى الفرن العاكس. تترواح درجة الحرارة في المحول ما بين 1150 و1315 ْم، ويبطن قاعه ومنطقة القصبات، وهى المنطقة المعرضة للبِلَى، بطوب من مغنسيا-كروم تُصب مصهورة.
أما أفران التخزين التى يحفظ ساخناً فيها النحاس المبثر الناتج من المحول قبل سبكه إلى بلاطات أو كتل، فإنها إما أن تكون أفران برميلية يمكن إمالتها أو أفران عاكسة ثابتة. ويتسعمل طوب قاعدى محروق (مكلس) لتبطين كلا النوعين من الأفران.
يحتوى النحاس المبثر على كميات كافية من الفلزات الثمينة تجعل عملية استعادتها عملية مجدية. وتتم عملية تنقية النحاس المبثر أولاً في فرن عاكس، ويسمى هذا الفرن بفرن الأنودات، لأن النحاس يصب في شكل أنودات. توضع الأنودات بعد ذلك في خلايا إلكتروليتية، حيث يترسب النحاس النقى على الكاثودات (المهابط). وتتجمع الفلزات الثمينة من الذهب والفضة والبلاتين والبلاديوم وغيرها في قاع الخلية، مكونة حمأة أو طَثْرَة. تسترد هذه المواد وتفصل منها الفلزات المتنوعة. تصهر الكاثودات الناتجة عن عملية التنقية في أفران تسمى أفران الأعواد، ثم تصب في شكل صبات، أم يمكن معالجتها بعد ذلك في فرن كهربائى للحصول على نحاس خالى من الأكسجين أو على نحاس فسفورى.
أما الأفران المستخدمة لصهر النحاس الثانوى فهى أفران عاكسة تشبه في التصميم أفران الأنودات وأفران الأعواد السابقة الذكر، ولكنها أصغر أحجاماً. تستخدم حراريات كربيد السليكون على نطاق واسع في مسابك النحاس وسبائكه. أما المصاهر الومضية فتستخدم الحرارة الناتجة من أكسدة الكبريت الموجود في خامة النحاس لتوفير الطاقة اللازمة للصهارة. الغازات العادمة المنبعثة من هذه العملية غنية بالكبريت مما يسهل عملية استرداده في صورة عنصرية (حرة) أو في صورة حمض كبريتيك. وتوجد عدة أساليب للصهارة الومضية، تتغير بتغير الحاجات إلى الوقود والأكسجين الإضافيين.
يوجد العديد من الأساليب المستمرة الحديثة لإنتاج النحاس المبثر مباشرة من الرُكازات المعدنية. وتتميز هذه الأساليب بتوفير الطاقة وسهولة مناولة المواد أثناء العمليات وانخفاض التكلفة الرأسمالية. وفى هذه العمليات المستمرة يتم اختيار الحراريات وفقاً لنفس الأسس المستخدمة في عمليات الصهارة المعتادة. ومن هذه الأساليب الحديثة أسلوب نورندا، ويستخدم فيه محول عادى طويل يدفع فيه بهواء غنى بالأكسجين إلى طبقة المخلوط الكبريتيدى من خلال 50 قصبة أو أكثر من أحد جوانب المحول.تبقى هذه القصبات مغمورة في المصهور طوال العملية ولا تُخرَج منه إلا في حالات الطوارئ.
أسلوب وركرا لا يختلف كثيراً عن أسلوب نورندا إلا أنه تستخدم فيه مفاعل مكون من فرن ذو مجمرة يشبه إلى حد كبير الفرن العاكس. والعملية التقليدية من هذا الأسلوب تدفع بالأكسجين إلى المخلوط الكبريتيدى المنصهر خلال مواسير ممتدة من السقف أو من الجدران الجانبية، مكونة منطقة استقرار داخل الفرن تنفصل فيها المكونات السائلة غير الممتزجة عن بعضها البعض، بحيث يمكن تفريغ الخبث مباشرة. وأسلوب متسوبيشى أسلوب آخر مستمر لإنتاج النحاس ولكنه مرحلى: حيث توصل ثلاثة أفران توصيلاً متعاقباً، بحيث يتدفق المخلوط الكبريتيدى والخبث وفى النهاية النحاس المبثر بالجاذبية من فرن إلى آخر خلال مجموعة الأفران. والأفران الثلاثة هى فرن الصهارة وفرن كهربائى للترسيب وفرن التحويل.
الاستخلاص بالإذابة (النض أو التصويل)
تستخدم هذه الطريقة لاستخلاص الفلز من خامه بوساطة مذيب كيميائي. فيتم استخلاص النحاس من الخامات التي لا تتفاعل مع الكيميائيات المستخدمة في عملية الطفو. وفي عملية الاستخلاص بالإذابة هذه، فإن الماء المحتوي على حمض الكبريتيك، أو الكيميائيات الأخرى، ينتشر خلال الخام، ويذيب النحاس. يُمزج المحلول بمذيب من الكيروسين يحتوي بعض المواد الكيميائية التي تستخلص النحاس. ينفصل المزيج ويسيل النحاس مع المواد الكيميائية في محلول حمض الكبريتيك. يتم وضع المحلول في صهريج لإجراء عملية الاستخلاص الكهروكيميائي التي تشبه عملية التنقية الكهربائية. النحاس الناتج من هذه العملية يكون بنقاوة 99,9%.
التنقية الكهربائية
يجب أن يُنقى النحاس المستخدم في الموصلات الكهربائيه إلى درجة نقاء أعلى من 99,9%. ومن أجل ذلك، يصب ويسبك النحاس النفطة في قوالب بمساحة 90سم² وسمك 8سم لقطع كعكية، وتؤدي هذه القطع دور المصعد (القطب الموجب) في العملية الإلكتروليتية. ولمزيد من القواعد الكيميائية الداخلة في هذه العملية،
توضع الأقطاب الموجبة داخل أحواض محتوية على محلول كبريتات النحاس، وحمض الكبريتيك، وتفصل تبادلياً بأقطاب سالبة (مهابط)، وهي ألواح رفيعة من النحاس النقي تسمى الألواح البادئة. وعندما يمر التيار الكهربائي من خلال الحوض تذوب المصاعد تدريجياً، مرسبة نحاساً بنقاوة 99,9% على المهابط. وأغلب الشوائب المتبقية في الأقطاب الموجبة تستقر في قاع الحوض مكونة راسباً طينياً. ويستخدم العاملون في تعدين النحاس طرقاً عدة لاستخلاص كميات ضئيلة من الذهب والفضة والبلاتين وفلزات أخرى من الراسب الطيني. وبعد عملية التحليل الكهربائي، تصهر المهابط النحاسية في فرن كهربائي، وتسبك في أشكال وأحجام متعددة مثل، القضبان، والكعكات والقطع والكتل.
الطرق
The concentration of copper in ores averages only 0.6%, and most commercial ores are sulfides, especially chalcopyrite (CuFeS2), bornite (Cu5FeS4) and, to a lesser extent, covellite (CuS) and chalcocite (Cu2S).[7] Conversely, the average concentration of copper in polymetallic nodules is estimated at 1.3%. The methods of extracting copper as well as other metals found in these nodules include sulphuric leaching, smelting and an application of the Cuprion process.[8][9] For minerals found in land ores, they are concentrated from crushed ores to the level of 10–15% copper by froth flotation or bioleaching.[10] Heating this material with silica in flash smelting removes much of the iron as slag. The process exploits the greater ease of converting iron sulfides into oxides, which in turn react with the silica to form the silicate slag that floats on top of the heated mass. The resulting copper matte, consisting of Cu2S, is roasted to convert the sulfides into oxides:[7]
- 2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2
The cuprous oxide reacts with cuprous sulfide to converted to blister copper upon heating:
- 2 Cu2O + Cu2S → 6 Cu + 2 SO2
The Sudbury matte process converted only half the sulfide to oxide and then used this oxide to remove the rest of the sulfur as oxide. It was then electrolytically refined and the anode mud exploited for the platinum and gold it contained. This step exploits the relatively easy reduction of copper oxides to copper metal. Natural gas is blown across the blister to remove most of the remaining oxygen and electrorefining is performed on the resulting material to produce pure copper:[11]
- Cu2+ + 2 e− → Cu
- Blister copper
- Smelting
- Reverberatory furnace
- Slag removal
- Copper casting of anodes
- Casting wheel
- Anodes removal machine
- Anodes take-off
- Rail cars
- Transportation to the tank house
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
وجوده في الطبيعة واستحصاله
يعدّ النحاس من المعادن متوسطة الانتشار في الطبيعة إذ لا تتجاوز نسبته في القشرة الأرضية 0.012% وزناً. ولخموله الكيمياوي يصادف في الطبيعة أحياناً بالحالة الحرة، ويصادف بصورة رئيسية على شكل مركّبات كبريتية، مثل CuS والشالكوسيت Cu2S والشالكوبريت CuFeS2 ومركّبات أكسجينية، مثل الكوبريت Cu2O وCuO والمالاكيت CuCO3Cu(OH)2، وCuSiO3.2H2O، وCu4(OH)6SO4. ويحصل على النحاس من مركّباته الأكسجينية بإرجاعه بالكربون. ولاستحصاله من مركّباته الحديدية الكبريتيه تحرق هذه المركّبات جزئياً، فيتأكسد الحديد بتمامه متحولاً إلى FeO ويفصل بشكل سيليكات الحديد بتفاعله مع أكسيد السيليكون SiO2، ويتحول جزء من Cu2S إلى Cu2O الذي يتفاعل مع Cu2S المتبقّي، فينفصل النحاس، وينطلق غاز ثنائي أكسيد الكبريت:
تبلغ نقاوة النحاس المحضر بهذه الطريقة 98%، وللحصول عليه نقياً جداً تستخدم إحدى الطريقتين الآتيتين:
1- الأكسدة بالهواء الساخن: تتم أكسدة جزء من النحاس (بنقاوة 98%) بأكسجين الهواء متحولاً إلى Cu2O الذي ينحل في النحاس المصهور الذي لم يتأكسد بعد. يتخلى Cu2O عن أكسجينه في هذا المزيج للمعادن المرافقة للنحاس على شكل شوائب سهلة الأكسدة، ويختزل ما تبقى من الأكسيد Cu2O بالفحم. تبلغ نقاوة النحاس الناتج بهذه الطريقة 99.5%.
2- التحليل الكهربائي: تجري هذه العملية في خلية كهربائية التحليل الكهركيمياوي يكون فيها الأنود من النحاس المشوب (98%)؛ والكاتود من النحاس النقي. يغمس الإلكترودان في محلول حمضي (مثل H2SO4) لكبريتات النحاس CuSO4، فينتقل النحاس في أثناء هذه العملية من الأنود إلى الكاتود. أما الشوائب فمنها ما يبقى عالقاً بالأنود (خاصة الحديد)، ومنها ما يترسب على شكل كبريتات عديمة الانحلال. تبلغ نقاوة النحاس المحضّر بهذه الطريقة 99.99%.
تصنيع المنتجات النحاسية
تنتج المنشآت الصناعية، مثل مصانع النحاس الأصفر (الصفر) والأسلاك، أشكالاً نصف مصنعة منها الألواح والأنابيب، والأسلاك، والقضبان. وتصنع هذه الأشكال من القضبان والكعكات، والكتل والقطع النحاسية، ويشتريها مصنعو منتجات النحاس.
ألواح النحاس
تصنع من كعكات النحاس ذات المقاسات 64 سم عرضًا و20 سم سمكًا و183 سم طولاً. وتسخن هذه الكعكات في فرن عند درجة حرارة 926°م ثم تلف على آلة دوارة على درجة عالية من الحرارة في شكل ألواح بسمك 13ملم، وتقوم آلات بتسوية الألواح للسمك المطلوب. ثم تقطع الألواح قطعًا بالأحجام المطلوبة لصنع منتجات مثل ألواح السقف وأواني الطبخ، وألواح الحفر الضوئي (حفر الكليشيهات). انظر: الحفر.
أنابيب النحاس
تصنع من كتل النحاس التي تتفاوت في نصف قطرها من ثمانية إلى 23سم، أما طولها فقد يبلغ 132سم. يسخن العمال الكتل في فرن ويثقبونها لتعطي أنبوباً خشناً، وتضغط هياكل الأنابيب خلال قوالب وأجهزة أخرى لصنع أنابيب الحجم المطلوب. وتستخدم هذه الأنابيب لصنع أنابيب الصرف الصحي، وخطوط الغاز بالمنازل والقنوات والأنابيب الكهربائية.
الأسلاك النحاسية
تصنع بعد صب المهابط النحاسية المنصهرة على هيئة قضبان عرضها 10سم وسمكها 7,5سم، تسوى القضبان في آلة دوارة لتكون بسمك 6ملم وتسحب بعد ذلك من خلال قوالب آلات سحب الأسلاك، وتشكل هذه القوالب القضبان إلى الأحجام المطلوبة. وتستخدم أغلب الأسلاك النحاسية لأغراض نقل التيار الكهربائي.
النحاس المنكبس
يكبس (ينبثق) النحاس أحياناً من خلال فتحة في قالب ليكون أشكالاً معينة، ويمكن أن ينبثق أيضاً في شكل قضبان وأنابيب، وأشكال أخرى خاصة، ويصنع منها المفصلات ومقابض الأبواب وأدوات معدنية أخرى.
خواصه الفيزيائية واستعمالاته
النحاس معدن ذو لون أصفر، عدده الذري 29، وزنه الذري 63.54، درجة انصهاره 1083.4 ْ، ودرجة غليانه 2595 ْس، القساوة (للألماس = 10) تساوي 3.0، نصف قطر ذرته 1.28 أنغستروم، المقاومة الحجمية الكهربائية (أي مقاومة مكعب من النحاس طول ضلعه 1سم) هي 1.6730 × 10-6 أوم. سم عند درجة حرارة 20 ْس، وتزداد مقاومة النحاس بارتفاع درجة الحرارة. له نظيران موجودان في الطبيعة هما 63Cu (نواته تحوي 29 بروتوناً و34 نتروناً)، و65Cu (نواته تحوي 29 بروتوناً و36 نتروناً). وله تسعة نظائر مشعة لها الأعداد الكتلية : 58، 59، 60، 61، 62، 64، 66، 67، 68.
| المعدن | الكهربائية | الحرارية |
|---|---|---|
| فضة | 106 | 108 |
| نحاس | 100 | |
| ذهب | 72 | 76 |
| بلاتين | 16 | 18 |
| أنتموان | 4.5 | 5 |
| نيكل | 25 | 15 |
- (الناقلية النسبية على أساس النحاس 100).
كمون نصف التفاعل (Cu2+/Cu) يساوي 0.34 فولت؛ أي إنه يقع فوق الهدروجين بالترتيب الكهرحركي.
يعدّ النحاس من المعادن القليلة التي تستعمل بشكلها النقي (يعدّ المعدن نقياً إذا كان يحوي 0.5% من عنصر أو عناصر أخرى)؛ ويعود ذلك إلى ناقليته العالية للكهرباء وللحرارة. ويبيّن الجدول (1) الناقلية الكهربائية والحرارية النسبية لعدد من المعادن النقية مقارنة بالنحاس عند درجة الحرارة20 ْس.
وتقلّل الشوائب الموجودة في معدن النحاس كثيراً من ناقليته الكهربائية. والكبريت أشد العناصر ضرراً بالنحاس. وفي الواقع اشتق اسم الكبريت من الكلمة اليونانية Sulvari؛ ومعناها «عدو النحاس».
للنحاس النقي استعمالات كثيرة لما يتميّزبه من ناقلية عالية للحرارة والكهرباء، ومقاومته للتآكل، وقابليته للسحب والطرق، وألوانه الجميلة، ويمكن التحكم بخواصه بالتلدين، وتوصيله ولحامه سهلان. ويستعمل النحاس وبعض مركّباته في تفاعلات الوساطة خاصة تفاعلات الأكسدة. وتدخل بعض مركّباته في تركيب كثير من الأصبغة المعدنية ومبيدات الحشرات والآفات الزراعية. ويأتي النحاس بعد الحديد والألمنيوم في الأهمية الصناعية.
يستعمل منه في التطبيقات الكهربائية 55% من الناتج الكلي و15% في البناء، و12% في صناعة السيارات و9% في صنع «المكنات» والمعدات الصناعية. وتستعمل سبائكه في مختلف الصناعات والانشاءات الهندسية. يراوح عدد سبائكه ما بين 150 و200. وهي ذات استعمالات واسعة، منها البرونز (90% نحاس + 10% قصدير)، والشبه (النحاس الأصفر) brass ت(60% نحاس +40% زنك)، والمنغانين (85% نحاس +12% منغنيز+3% نيكل)، والكونستانتان (59% نحاس +40% نيكل +1% منغنيز).
خواصه الكيمياوية
للنحاس البنية الإلكترونية: s1s2s22p63s23p64s13d10d؛ أي إنه يحوي إلكتروناً واحداً في المدار الخارجي s، مثل المعادن القلوية[ر: القلويات]. فالبوتاسيوم ذو العدد الذري 19 والذي يقع في الدور نفسه الذي يوجد به النحاس له البنية الإلكترونية s1s22s22p63s23p64s1s. لكن الفرق شاسع بين نشاط البوتاسيوم والنحاس؛ فالنحاس لا يستطيع إزاحة الهدروجين من الحموض، وهو لا يتأثر بأكسجين الهواء.
يتأكسد أيون النحاس الأحادي بسهولة إلى أيون نحاس +2. ويمكن تثبيت النحاس +1 بتكوين مركّبات قليلة الانحلال، مثل CuCl أو مركّبات معقدة [المعقّد] مثل NaCuCl2.
أيون النحاس Cu2+ اللامائي لا لون له، ولكن الأيون المميّه أزرق. يترسب Cu(OH)2 بإضافة هدروكسيد الأمونيوم NH4OH إلى محلول Cu2+، ويعود هذا الراسب فينحل لتشكل معقد نشادري:
لا ينحل هدروكسيد النحاس بزيادة من أساس قوي لأنه ليس أمفوتيرياً (مذبذباً).
أهم أملاح النحاس كبريتات النحاس خماسية الماء CuSO4.5H2O التي تسمى الزاج الأزرق، وبتسخينها عند الدرجة 100 ْس تتحول إلى CuSO4.H2O ويخسر ماءه جميعه عند الدرجة 250 ْس. وهي تستعمل كثيراً مبيداً للحشرات والفطور لأن أيون النحاس سام لهذه الأحياء.)..[12]
الدور الحيوي

السمية
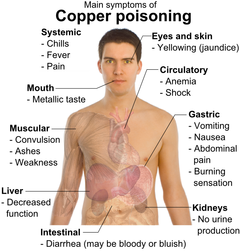
 مقالة مفصلة: تسمم النحاس
مقالة مفصلة: تسمم النحاس
يتواجد النحاس بشكل طبيعى في البيئة من حولنا. وقد استخدم الإنسان النحاس على نطاق واسع منذ القدم حيث تم تطبيقه في مجال الصناعة والزراعة. وقد تزايد إنتاج النحاس على مر العقود الماضية نتيجة لتوافر كمياته في البيئة. يتواجد النحاس في العديد من الأطعمة، في مياه الشرب وفى الهواء، ولذا فإن جسم الإنسان يمتص هذا المعدن يومياً من خلال الشرب وتناول الأطعمة ومن خلال التنفس أيضاً. هذا الامتصاص هام جداً لصحة الإنسان، وفى نفس الوقت تناول الكميات الكبيرة منه وبتركيزات عالية يكون ضار جداً بصحة الإنسان.[14]:
تستقر مركبات النحاس في الماء أو في جزيئات التربة، أما مركباته القابلة للذوبان فمازالت هى التى تشكل الخطر الأعظم لصحة الإنسان. وبداية انتشار مركبات النحاس القابلة للذوبان كانت بعد استخدامه في الزراعة. أما تركيزات معدن النحاس في الهواء تكون عادة بنسب منخفضة، فأضراره التى تلحق بالإنسان من خلال التنفس لا يُلتفت إليها، لكن الأشخاص التى تعيش بالقرب من أماكن صهر المعادن تتعرض لمخاطره.
أما في المنازل التى تكون مواسير المياه فيها مصنعة من النحاس، عند صدأها وتآكلها تبدأ مياه الشرب في التلوث.
تلوث المياه بالنحاس الأحمر ويشمل على تلوث المياه العذبة وتلوث البيئة البحرية: التعرض المهنى لهذا المعدن وارد أيضاً وهذا ما يُعرف (بالحمى المعدنية Metal fever)، حيث تشبه أعراضها الأنفلونزا، وتنتهى أعراض هذه الحالة في خلال يومين وتنتج هذه الحمى نتيجة للحساسية الزائدة من النحاس. التعرض على المد الطويل لمعدن النحاس يسبب تهيج للأنف والفم والعين، كما يسبب الصداع، آلام المعدة، الدوار، القىء، الإسهال.
تناول كميات كبيرة من النحاس عن عمد قد يؤدى إلى ضمور الكلى والكبدومن ثَّم حالات من الوفاة البشرية، أما كونه أحد مسببات السرطان فلم يتم التوصل بعد إلى ذلك. وهناك مقالات علمية تشير إلى الصلة بين التعرض الطويل للتركيزات العالية من النحاس وبين انخفاض القدرة الذكائية لبعض المراهقين الصغار وهذا يدعو إلى أن يكون هناك مزيداُ من البحث والتقصى.
التعرض الصناعى لأدخنة النحاس تؤدى إلى إصابة الإنسان (بحمى الدخان المعدنية Metal fume fever) مع تغير في الأغشية المخاطية للأنف، أما التسمم المزمن منه يصيب الإنسان بمرض ويلسون Wilson disease، وتتمثل أعراضه في التليف الكبدى، تلف خلايا المخ، أمراض الكلى، ترسبات النحاس في القرنية.
مخاطر مختلفة
The metal, when powdered, is a fire hazard. At concentrations higher than 1 mg/L, copper can stain clothes and items washed in water.
انظر أيضاً
المصادر
ديورانت, ول; ديورانت, أرييل. قصة الحضارة. ترجمة بقيادة زكي نجيب محمود.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. Archived from the original (PDF) on 2011-03-03.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ "Dime". US Mint. Retrieved 9 July 2019.
- ^ "Pride and skill – the 10-cent coin". Royal Canadian Mint. Retrieved 9 July 2019.
- ^ وليد خليفة. "الحراريات المستخدمة في صناعة الفلزات (5)". نول. Retrieved 2012-03-28.
- ^ أ ب Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Su, Kun; Ma, Xiaodong; Parianos, John; Zhao, Baojun (2020). "Thermodynamic and Experimental Study on Efficient Extraction of Valuable Metals from Polymetallic Nodules". Minerals. 10 (4): 360. Bibcode:2020Mine...10..360S. doi:10.3390/min10040360.
- ^ International Seabed Authority. "Polymetallic Nodules" (PDF). International Seabed Authority. Retrieved 8 February 2021.
- ^ Watling, H.R. (2006). "The bioleaching of sulphide minerals with emphasis on copper sulphides – A review" (PDF). Hydrometallurgy. 84 (1): 81–108. doi:10.1016/j.hydromet.2006.05.001. Archived from the original (PDF) on 18 August 2011.
- ^ Samans, Carl (1949). Engineering metals and their alloys. New York: Macmillan. OCLC 716492542.
- ^ النحاس, الموسوعة العربية
- ^ MedlinePlus > Copper poisoning Update Date: 2/3/2009. Updated by: A.D.A.M. Editorial Team: David Zieve, MD, MHA, Greg Juhn, MTPW, David R. Eltz. Previously reviewed by Stephen C Acosta, MD, Department of Emergency Medicine, Portland VA Medical Center, Portland, OR. Review provided by VeriMed Healthcare Network (10/30/2008). Retrieved on 18 Mars, 2009
- ^ المعادن الثقيلة.. سموم بيئية، فيدو
وصلات خارجية
- National Pollutant Inventory - Copper and compounds fact sheet
- Copper Resource Page. Includes 12 PDF files detailing the material properties of various kinds of copper, as well as various guides and tools for the copper industry.
- The Copper Development Association has an extensive site of properties and uses of copper; it also maintains a web site dedicated to brass, a copper alloy.
- The Third Millennium Online page on Copper
- The WebElements page on Copper
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||